
Wetenschap
Wat zijn de fysieke veranderingen in kalium?
Dit is waarom:
* kalium is een element: Elementen zijn de eenvoudigste vorm van materie en kunnen niet op fysieke middelen worden opgesplitst in eenvoudigere stoffen.
* Fysieke veranderingen: Fysieke veranderingen veranderen het uiterlijk of de vorm van een stof, maar veranderen de chemische samenstelling ervan niet. Voorbeelden zijn smelten, bevriezing, koken, sublimatie en condensatie.
* Chemische veranderingen: Chemische veranderingen resulteren in de vorming van nieuwe stoffen met verschillende chemische eigenschappen. Voorbeelden zijn verbranding, roesten en koken.
U kunt echter praten over de fysieke eigenschappen van kalium:
* Staat van materie: Bij kamertemperatuur is kalium een zachte, zilverwitte vaste stof.
* Dichtheid: Kalium is een zeer licht metaal met een dichtheid van 0,862 g/cm³.
* smeltpunt: Kalium smelt bij 63,5 ° C (146,3 ° F).
* kookpunt: Kalium kookt bij 759 ° C (1398 ° F).
* Reactiviteit: Kalium is zeer reactief en reageert met lucht en water om kaliumhydroxide (KOH) te vormen.
Samenvattend:
Kalium zelf ondergaat geen fysieke veranderingen zoals bevriezen of koken. In plaats daarvan heeft het specifieke fysieke eigenschappen die het uiterlijk, de dichtheid en het gedrag beschrijven.
 Wat gebeurt er met de dichtheid als je het volume hetzelfde houdt en de massa van de substantie vergroot?
Wat gebeurt er met de dichtheid als je het volume hetzelfde houdt en de massa van de substantie vergroot?  MOF-gegevensset biedt 10, 000 structuren gratis voor academisch onderzoek
MOF-gegevensset biedt 10, 000 structuren gratis voor academisch onderzoek De thermische geleidbaarheid van polymeren regelen met licht
De thermische geleidbaarheid van polymeren regelen met licht Gelatine kan binnenkort onze wearables en IoT-apparaten van stroom voorzien
Gelatine kan binnenkort onze wearables en IoT-apparaten van stroom voorzien Nieuw onderzoek voorspelt wanneer en hoe materialen zullen werken
Nieuw onderzoek voorspelt wanneer en hoe materialen zullen werken
 Hoe wetenschap en technologie onze manier van leven kunnen verbeteren of aantasten?
Hoe wetenschap en technologie onze manier van leven kunnen verbeteren of aantasten?  Britse temperatuurrecords tuimelden in 2019
Britse temperatuurrecords tuimelden in 2019 NASA vangt orkaan Dora op maximale sterkte, voordat de verzwakking begon
NASA vangt orkaan Dora op maximale sterkte, voordat de verzwakking begon Dodelijkste bosbranden in de Verenigde Staten sinds de jaren negentig
Dodelijkste bosbranden in de Verenigde Staten sinds de jaren negentig Subductie-initiatie kan afhankelijk zijn van een geschiedenis van tektonische platen
Subductie-initiatie kan afhankelijk zijn van een geschiedenis van tektonische platen
Hoofdlijnen
- Waarom ouders in hun beste jaren de beste nakomelingen voortbrengen
- Waarom is het belangrijk om resultaten te kunnen reproduceren?
- Hoe de malariaparasiet menselijke rode bloedcellen kaapt
- Meer waarnemingen van een bedreigde diersoort betekent niet altijd dat deze zich herstelt
- 'Veggie'-dinosaurussen verschilden in de manier waarop ze hun voedsel aten
- Metabolisme heeft een directe invloed op de kans op het ontwikkelen van malaria
- Welk experiment leidde tot de oorspronkelijke celtheorie?
- De primaire primaire productiviteit berekenen
- Wat doen eukaryotisch?
- Innovatiepioniers scoren wereldprimeur voor duurzaam bouwen met grafeenbeton

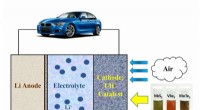
- Met 2D-materialen kunnen elektrische voertuigen 500 mijl afleggen op één lading
- Wetenschappers analyseren structuur, mechanisme van faageiwit dat elektronen steelt

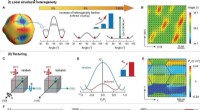
- Ultrahoge piëzo-elektrische prestaties aangetoond in keramische materialen
- Onderzoek onderzoekt samenspel van eiwitten bij diabetes type 2
 Kikker en menselijke bloedcellen vergelijken en identificeren
Kikker en menselijke bloedcellen vergelijken en identificeren  Eetbare coating voor het bewaren van zeebaars
Eetbare coating voor het bewaren van zeebaars Nieuwe methode verbetert de nauwkeurigheid van beeldvormingssystemen
Nieuwe methode verbetert de nauwkeurigheid van beeldvormingssystemen Katalyserend proces met lignine kan 100% duurzame vliegtuigbrandstof mogelijk maken
Katalyserend proces met lignine kan 100% duurzame vliegtuigbrandstof mogelijk maken Een grootse, verenigde theorie van exotische supergeleiding?
Een grootse, verenigde theorie van exotische supergeleiding?  Een nieuwe techniek om spannende metaaloxideframes te maken
Een nieuwe techniek om spannende metaaloxideframes te maken Gelijktijdige detectie van meerdere spintoestanden in een enkele kwantumdot
Gelijktijdige detectie van meerdere spintoestanden in een enkele kwantumdot Wat is dodelijke fase en hoe wordt het berekend?
Wat is dodelijke fase en hoe wordt het berekend?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

