
Wetenschap
Wat gebeurt er als u calciumhydroxide en ammoniumchloride mengt?
* calciumchloride (CACL₂) - een oplosbaar zout
* ammoniak (NH₃) - een gas met een scherpe geur
* water (h₂o) - een vloeistof
De evenwichtige chemische vergelijking voor deze reactie is:
ca (oh) ₂ (aq) + 2nh₄cl (aq) → cacl₂ (aq) + 2nh₃ (g) + 2h₂o (l)
Hier is een uitsplitsing van wat er gebeurt:
1. Oplossing: Zowel calciumhydroxide als ammoniumchloride lossen op in water, waardoor hun respectieve ionen worden gevormd:
* ca (oh) ₂ → ca²⁺ + 2oH⁻
* 2NH₄CL → 2NH₄⁺ + 2Cl⁻
2. ionenuitwisseling: De calciumionen (ca²⁺) van calciumhydroxide reageren met de chloride -ionen (CL⁻) uit ammoniumchloride, waardoor calciumchloride (CACL₂) wordt gevormd, die in de oplossing is opgelost.
3. Vorming van ammoniak: De hydroxide -ionen (OH⁻) van calciumhydroxide reageren met de ammoniumionen (NH₄⁺) uit ammoniumchloride. Deze reactie produceert ammoniakgas (NH₃) en water (H₂o).
4. Gasevolutie: Het ammoniakgas, minder oplosbaar in water, ontsnapt in de atmosfeer en geeft een karakteristieke scherpe geur af.
Observaties:
* U zou zien dat de oplossing bewolkt wordt als calciumhydroxide oplost.
* Je zou ook een afzonderlijke ammoniakgeur opmerken, die intensiveert naarmate de reactie vordert.
* De oplossing kan enigszins opwarmen vanwege de exotherme aard van de reactie.
Over het algemeen is de reactie tussen calciumhydroxide en ammoniumchloride een klassiek voorbeeld van een dubbele verplaatsingsreactie die leidt tot de vorming van een gas en een zout.
 Eenvoudige en snelle pH-experimenten met Litmus
Eenvoudige en snelle pH-experimenten met Litmus Voorbereiding van zilveroxide uit zilvernitraat
Voorbereiding van zilveroxide uit zilvernitraat De effecten van zure regen op begraafplaatsen Stenen
De effecten van zure regen op begraafplaatsen Stenen Wetenschappers komen met nanobeton voor gieten onder negatieve temperatuuromstandigheden
Wetenschappers komen met nanobeton voor gieten onder negatieve temperatuuromstandigheden Chemici verrassende ontdekking van nano-beperkte reacties kunnen helpen bij katalytisch ontwerp
Chemici verrassende ontdekking van nano-beperkte reacties kunnen helpen bij katalytisch ontwerp
 Californië stelt strenge limiet voor giftige chemicaliën in drinkwater voor
Californië stelt strenge limiet voor giftige chemicaliën in drinkwater voor Intelligente sproeiers klaar om de boomkwekerijsector te transformeren
Intelligente sproeiers klaar om de boomkwekerijsector te transformeren NASA-laser synchroniseren, ESA-radar voor een nieuwe kijk op zee-ijs
NASA-laser synchroniseren, ESA-radar voor een nieuwe kijk op zee-ijs Graven in de Arctische modder voor antwoorden op klimaatverandering
Graven in de Arctische modder voor antwoorden op klimaatverandering Conserveringskosten kunnen hoger zijn dan verwacht
Conserveringskosten kunnen hoger zijn dan verwacht
Hoofdlijnen
- Te veel voertuigen, trage reacties en roekeloos samenvoegen:nieuw wiskundig model legt uit hoe verkeersbacteriën bewegen
- Wetenschappers stellen voor om locatiegegevens van mobiele apparaten te gebruiken voor het bestuderen van interacties tussen mens en natuur
- Wat is een voorbeeld van een niet -schadelijke bacteriën?
- Wat is de eenheid van natuurlijke selectie?
- Welke structuur in de cellen Nucleus bevat erfelijke informatie?
- Waarom vormen nieuwe biologische macromoleculen zich vandaag abiotisch uit niet -levende materie op aarde?
- Hoe cellen onafhankelijk worden en functies reguleren
- Wat gebeurt er als je organisme?
- Hoeveel takken van BSC -wetenschap zijn er?
- Ultrasnelle waterstofbrugdynamiek van vloeibaar water onthuld door THz-geïnduceerd Kerr-effect
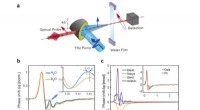
- Onderzoekers valideren klinische haalbaarheid voor op CRISPR gebaseerde COVID-19-tests op het zorgpunt
- Steenkool onthult een verfijnde kant:vuile koolstof kan worden gebruikt om een verscheidenheid aan nuttige apparaten te maken

- Lichtgevoelige E. coli functionele biofilms als steigers voor hydroxyapatietmineralisatie
- Instrument kan mail-in-testen mogelijk maken om zware metalen in water te detecteren

 Wat is Mercurius?
Wat is Mercurius?  Kameleonmaterialen:de oorsprong van kleurvariatie in laagdimensionale perovskieten
Kameleonmaterialen:de oorsprong van kleurvariatie in laagdimensionale perovskieten Opheldering van trillingsenergie van een enkel molecuul in een extern krachtveld
Opheldering van trillingsenergie van een enkel molecuul in een extern krachtveld Welke soorten stollingsgesteente afgekoeld van magma?
Welke soorten stollingsgesteente afgekoeld van magma?  Industriële brom in de VS in kaart brengen
Industriële brom in de VS in kaart brengen Nieuw papier biedt doorbraak op het gebied van knipperende moleculen
Nieuw papier biedt doorbraak op het gebied van knipperende moleculen Het verschil tussen onderzoeksvragen & hypothese
Het verschil tussen onderzoeksvragen & hypothese
Onderzoeksvragen en hypothesen zijn hulpmiddelen die op vergelijkbare manieren worden gebruikt voor verschillende onderzoeksmethoden. Zowel hypothesen als onderzoeksvragen worden geschreven voordat h
 Is fluor -ionisatie -energie hoog of laag?
Is fluor -ionisatie -energie hoog of laag?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

