
Wetenschap
Waarom dacht John Dalton dat elementen zijn gemaakt van afzonderlijke atomen?
1. Law of Conservation of Mass: Dalton merkte op dat in chemische reacties de totale massa van de reactanten altijd gelijk is aan de totale massa van de producten. Dit bracht hem ertoe te geloven dat materie niet werd vernietigd of gecreëerd, maar eerder herschikt. Hij redeneerde dat dit kon worden verklaard als materie bestond uit kleine, ondeelbare deeltjes (atomen).
2. Wet van definitieve verhoudingen: Dalton merkte ook op dat chemische verbindingen altijd dezelfde elementen in dezelfde verhoudingen bevatten door massa. Water bevat bijvoorbeeld altijd 11,1% waterstof en 88,9% zuurstof per massa, ongeacht de bron. Hij legde dit uit door te suggereren dat verbindingen worden gevormd door de combinatie van specifieke aantallen atomen van elk element.
3. Wet van meerdere verhoudingen: Deze wet stelt dat wanneer twee elementen meer dan één verbinding vormen, de massa's van het ene element die combineren met een vaste massa van het andere element zijn in verhoudingen van kleine hele getallen. Koolstof en zuurstof kunnen bijvoorbeeld zowel koolmonoxide (CO) als koolstofdioxide (CO2) vormen. De verhouding van zuurstof in deze twee verbindingen is 1:2. Dit versterkte het idee van Dalton verder dat verbindingen werden gevormd door de combinatie van atomen in vaste verhoudingen.
4. Eenvoud en elegantie: De theorie van Dalton was opmerkelijk eenvoudig en elegant. Het gaf een verenigende verklaring voor een reeks chemische observaties die eerder niet verbonden waren. Deze eenvoud maakte het destijds aantrekkelijk voor wetenschappers en droeg bij aan de wijdverbreide acceptatie.
Het is belangrijk op te merken dat de theorie van Dalton niet zonder fouten was. Het verklaarde niet voor het bestaan van subatomaire deeltjes en het ging ten onrechte aan dat atomen ondeelbaar waren. Zijn theorie legde echter de basis voor de moderne atoomtheorie en zijn ideeën over de aard van atomen brachten een revolutie teweeg in ons begrip van materie.
 Video:Op weg naar nul koolstof met David Attenborough en Jane Goodall
Video:Op weg naar nul koolstof met David Attenborough en Jane Goodall Op zoek naar liefde:hoe we onszelf voor de gek kunnen houden als we iemand leuk vinden
Op zoek naar liefde:hoe we onszelf voor de gek kunnen houden als we iemand leuk vinden  Wat voor soort carnivoor woont in het grasland van Prairie?
Wat voor soort carnivoor woont in het grasland van Prairie?  Alaska's drukke vulkaan:zeewater, magmafiguur bij uitbarstingen
Alaska's drukke vulkaan:zeewater, magmafiguur bij uitbarstingen Waarom oceaanvervuiling een duidelijk gevaar is voor de menselijke gezondheid
Waarom oceaanvervuiling een duidelijk gevaar is voor de menselijke gezondheid
Hoofdlijnen
- Dugongs zullen waarschijnlijk functioneel uitgestorven zijn in China
- Wat is de pH van een mierenspuit?
- Wat is een gen?
- Omgeving speelt sleutelrol bij veranderend bewegingsgedrag van dieren
- Onderzoekers willen weten waarom beluga-walvissen nog niet zijn hersteld
- Wat is het belangrijkste onderdeel van de wetenschappelijke methode?
- Wat is de rol van centriolen?
- Wat is de naam van enzymen die activiteiten regelen die andere eiwitten regelen door ze te fosforyleren?
- Welke van de volgende is een voorbeeld van meerdere allel erfelijkheid een zaadtextuur B huidskleur in kikkers c patronen Andalusische kip d menselijke bloedtypen?
- Een moleculaire motor gebruiken om de voorkeur van anionbindende katalysatoren te veranderen
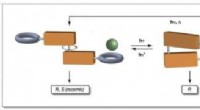
- Roestige polymeren maken voor energieopslag
- Atomair gedispergeerd Ni is cokesbestendig voor droge reforming van methaan

- Een visuele database van menselijke plasmaverbindingen

- Bekledingstests tonen aan dat vocht de Grenfell-vlammen mogelijk heeft versneld

 Wat was er eerst:zwarte gaten of sterrenstelsels?
Wat was er eerst:zwarte gaten of sterrenstelsels?  Bang voor de verkiezingen? Politieke wetenschappers leggen uit waarom
Bang voor de verkiezingen? Politieke wetenschappers leggen uit waarom  Een molecuul dat werkt als een nanobatterij
Een molecuul dat werkt als een nanobatterij De voordelen van het bestuderen van cellen onder een lichtmicroscoop
De voordelen van het bestuderen van cellen onder een lichtmicroscoop 3D-printen vormt bouwindustrie, creëert snel bouwpotentieel
3D-printen vormt bouwindustrie, creëert snel bouwpotentieel Onderzoek toont aan dat sociale media en zoekmachines beter zijn dan hun reputatie doet vermoeden
Onderzoek toont aan dat sociale media en zoekmachines beter zijn dan hun reputatie doet vermoeden Wetenschappers bevelen een aangepast regionaal klimaatmodel aan boven Zuidoost-Azië
Wetenschappers bevelen een aangepast regionaal klimaatmodel aan boven Zuidoost-Azië Ultradunne gespoten MXene-antennes zijn klaar voor 5G
Ultradunne gespoten MXene-antennes zijn klaar voor 5G
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

