
Wetenschap
Een molecuul dat werkt als een nanobatterij

Het HPC-cluster "CARL" hielp het gedrag van het molecuul te ontcijferen door middel van uitgebreide berekeningen. Credit:Daniel Schmidt/Universiteit van Oldenburg
Hoe werken moleculaire katalysatoren – moleculen die, zoals enzymen, kan bepaalde chemische reacties veroorzaken of versnellen - functie, en welke effecten hebben ze? Een team van chemici van de Universiteit van Oldenburg is dichter bij de antwoorden gekomen met behulp van een modelmolecuul dat functioneert als een moleculaire nanobatterij. Het bestaat uit verschillende titaniumcentra die met elkaar zijn verbonden door een enkele laag onderling verbonden koolstof- en stikstofatomen. Het zevenkoppige onderzoeksteam publiceerde onlangs zijn bevindingen, die de resultaten van drie meerjarige Ph.D. onderzoeksproject, in ChemPhysChem . Het tijdschrift voor fysische chemie en chemische fysica stond op de omslag van het fundamentele onderzoek uit Oldenburg.
Om beter te begrijpen hoe het molecuul werkt, de onderzoekers, onder leiding van eerste auteurs Dr. Aleksandra Markovic en Luca Gerhards en corresponderend auteur Prof. Dr. Gunther Wittstock, voerden elektrochemische en spectroscopische experimenten uit en gebruikten het high-performance computing-cluster van de universiteit voor hun berekeningen. Wittstock ziet de publicatie van het artikel als een "succesverhaal" voor beide Research Training Groups waarbinnen de Ph.D. projecten werden uitgevoerd en voor het rekencluster van de universiteit. "Zonder de krachtige computerinfrastructuur, we zouden niet in staat zijn geweest om de uitgebreide berekeningen uit te voeren die nodig zijn om het gedrag van het molecuul te ontcijferen, ", zegt Wittstock. "Dit onderstreept het belang van dergelijke rekenclusters voor huidig onderzoek."
In de krant, de auteurs presenteren de resultaten van hun analyse van een moleculaire structuur, het prototype waarvoor het resultaat was van een onverwachte chemische reactie die voor het eerst werd gerapporteerd door de scheikundeafdeling van de Universiteit van Oldenburg in 2006. Het is een zeer complexe moleculaire structuur waarin drie titaniumcentra (in de middelbare schoollessen gewoonlijk titaniumionen genoemd) zijn verbonden met elkaar verbonden door een overbruggingsligand bestaande uit koolstof en stikstof. Zo'n verbinding zou naar verwachting in staat zijn om meerdere elektronen op te nemen en af te geven door onder andere de uitwisseling van elektronen tussen de metaalcentra.
Het verkrijgen van een goed begrip van deze processen is van bijzonder belang, niet alleen voor fundamenteel onderzoek, maar ook voor het op gang brengen of versnellen van belangrijke reacties waarbij meer dan één elektron wordt overgedragen. Dergelijke reacties blijven een grote uitdaging in technische systemen, waarvoor nog geen bevredigende oplossing bestaat. "Veel inspanningen zijn momenteel gericht op deze doelstelling, ", zegt Wittstock. Een voorbeeld is brandstofceltechnologie, die de gelijktijdige overdracht van vier elektronen naar één zuurstofmolecuul vereist om een stroom van elektronen van waterstof naar zuurstof te bereiken, hij legt uit. "Dergelijke multi-elektronreacties hebben ook een groot potentieel om materialen of energie te besparen bij de chemische productie."
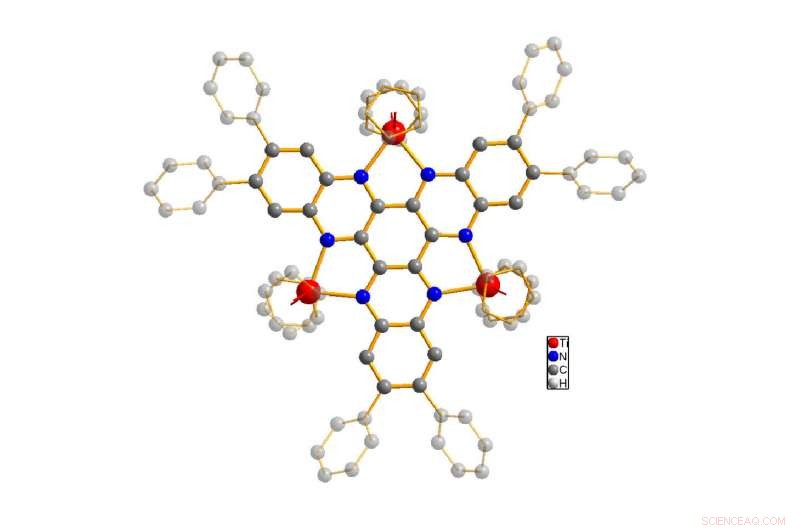
De structuur van het bestudeerde molecuul (titanium weergegeven in rood, stikstof in blauw, koolstof in grijs). Het basislichaam van het molecuul wordt gemarkeerd, terwijl waterstofatomen zijn verborgen voor vereenvoudiging. Krediet:Ruediger Beckhaus / Universiteit van Oldenburg
De moleculaire modelverbinding, bestaande uit het overbruggende ligand en de titaniumcentra, is speciaal ontworpen om de wetenschappers te helpen een gedetailleerd begrip te krijgen van hoe verbindingen met verschillende metaalcentra elektronen kunnen accepteren en vrijgeven. De wetenschappers prikkelden het molecuul door licht, waarop de moleculen verschillend reageerden, afhankelijk van het aantal geaccepteerde en vrijgegeven elektronen. Helaas, het in 2006 gemaakte molecuul bleek slecht oplosbaar in de meeste oplosmiddelen en daardoor moeilijk te bestuderen. Met behulp van chemische synthese, Dr. Pia Sander, een co-auteur van het artikel, propellerachtige moleculaire motieven aan de verbinding toegevoegd om de oplosbaarheid te verbeteren. Dit vormde de basis voor de experimenten van Markovic, waaruit bleek dat de modelverbinding in totaal drie elektronen kon accepteren of zes elektronen kon afgeven - een ongewoon hoge capaciteit voor een enkel molecuul. Bij elk van deze reacties niet alleen de zichtbare kleur van het molecuul verandert, maar de absorptie van licht in de spectrale bereiken die onzichtbaar zijn voor het menselijk oog. aanvankelijk, echter, de precieze veranderingen in het molecuul met verschillende aantallen elektronen konden op basis van die spectrale bereiken niet worden bepaald.
Hier kwamen Luca Gerhards en het computercluster van de universiteit om de hoek kijken. Hoewel veelvoorkomende verklaringen gebaseerd zijn op de premisse dat bij elke door licht opgewekte overgang alleen de energie van een enkel elektron verandert, co-auteur Gerhards vermeed deze vereenvoudigende aannames in zijn kwantumchemische vergelijkingen. Dit maakte de berekeningen nog complexer en hield het high-performance rekencluster maandenlang bezig. Uiteindelijk, het resultaat kwam als een verrassing voor alle betrokkenen:verschillende elektronen veranderen tegelijkertijd hun energieniveau wanneer licht het bestudeerde molecuul raakt. Bovendien, deze lading wordt niet opgeslagen in het titanium, zoals zou worden verwacht, maar voornamelijk in het overbruggende ligand, de 'link' tussen de titanium centra.
Zoals Wittstock uitlegt, de metalen centra zorgen dus voor een positief geladen "frame" voor elektronenopslag, als in een "nanobatterij". Het modelmolecuul - en bij uitbreiding een hele klasse van vergelijkbare verbindingen - is een "minisegment van een energieopslagmateriaal" gebleken. Hoewel hun volledige potentieel in dit stadium niet kan worden bepaald, Wittstock is van mening dat dergelijke "frames" met moleculaire ladingsopslagmotieven een nieuw ontwerpelement kunnen worden in complexe moleculaire katalysatoren voor multi-elektronreacties.
 Onderzoekers rapporteren mogelijke oplossingen voor moeilijk te recyclen kunststoffen
Onderzoekers rapporteren mogelijke oplossingen voor moeilijk te recyclen kunststoffen Betere omzetting van biomassa voor biobrandstoffen en bioproducten
Betere omzetting van biomassa voor biobrandstoffen en bioproducten Wetenschappers zoeken naar nieuwe benaderingen om geregenereerd uranium te verrijken
Wetenschappers zoeken naar nieuwe benaderingen om geregenereerd uranium te verrijken Wetenschappers ontdekken groenere manier om plastic te maken
Wetenschappers ontdekken groenere manier om plastic te maken Duurzame bioplastics maken van elektriciteitsetende microben
Duurzame bioplastics maken van elektriciteitsetende microben
 Nieuw op satellieten gebaseerd algoritme lokaliseert het gebruik van gewaswater
Nieuw op satellieten gebaseerd algoritme lokaliseert het gebruik van gewaswater Het diepe verleden van de Noordelijke IJszee biedt aanwijzingen voor de nabije toekomst
Het diepe verleden van de Noordelijke IJszee biedt aanwijzingen voor de nabije toekomst Vroegere diepwaterdynamiek in de westelijke tropische Stille Oceaan
Vroegere diepwaterdynamiek in de westelijke tropische Stille Oceaan Nieuw-Zeeland introduceert baanbrekende nulkoolstofrekening, inclusief doelen voor landbouwmethaan
Nieuw-Zeeland introduceert baanbrekende nulkoolstofrekening, inclusief doelen voor landbouwmethaan Studie synthetiseert wat klimaatverandering betekent voor bosbranden in het noordwesten
Studie synthetiseert wat klimaatverandering betekent voor bosbranden in het noordwesten
Hoofdlijnen
- Een klassieke darwinistische ecologische hypothese houdt stand - met een twist
- Difference Between Gap Junctions & Plasmodesmata
- Relatie tussen ademhaling en stofwisseling
- Het veredelen van zeer productieve maïs heeft zijn aanpassingsvermogen verminderd
- Misplaatste monarchen:clusters van vlinders in het noorden
- Hoe genenbanken werken
- Vergelijking van klonen met mitose
- Sociale vaardigheden van honden gekoppeld aan gevoeligheid voor oxytocine
- Wat gebeurt er als je een lijk ontdooit?
- Kathodedefecten verbeteren de batterijprestaties

- Risicovrije gen-reactivering

- Energie halen uit licht met behulp van bio-geïnspireerde kunstmatige cellen
- Vlam aan! Hoe AI een complexe materiaaltechniek kan temmen en de productie kan transformeren

- Moleculair dunne hybride perovskiet voor geavanceerde opto-elektronische toepassingen

 Tijdstip van vogelmigratie vertekend door klimaat, nieuwe onderzoeksresultaten
Tijdstip van vogelmigratie vertekend door klimaat, nieuwe onderzoeksresultaten 3D-modellen van meerlagige structuren op technische schaal van schadeprofielen op nanoschaal
3D-modellen van meerlagige structuren op technische schaal van schadeprofielen op nanoschaal Gemeenschappelijk nanodeeltje heeft subtiele effecten op genen voor oxidatieve stress
Gemeenschappelijk nanodeeltje heeft subtiele effecten op genen voor oxidatieve stress Romeins theater ontdekt aan de voet van de Westelijke Muur van Jeruzalem
Romeins theater ontdekt aan de voet van de Westelijke Muur van Jeruzalem Computermodel onthult effect van verhoogd cholesterol op specifiek ionkanaal in hart
Computermodel onthult effect van verhoogd cholesterol op specifiek ionkanaal in hart Nieuw klimaatrapport is een onmiddellijke oproep tot actie
Nieuw klimaatrapport is een onmiddellijke oproep tot actie Kunstmatige intelligentie ontsluit mysteries over extreem weer
Kunstmatige intelligentie ontsluit mysteries over extreem weer Hoe Rocketcam werkt
Hoe Rocketcam werkt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

