
Wetenschap
Waarom gedragen leden van een gezinselementen hetzelfde in chemische reacties?
Dit is waarom:
* valentie -elektronen: Dit zijn de elektronen in het buitenste energieniveau van een atoom. Zij zijn degenen die betrokken zijn bij chemische binding.
* chemische binding: Atomen vormen bindingen door valentie -elektronen te delen of over te dragen.
* Vergelijkbare reactiviteit: Omdat elementen in dezelfde familie hetzelfde aantal valentie -elektronen hebben, hebben ze de neiging om vergelijkbare soorten bindingen te vormen en deel te nemen aan vergelijkbare chemische reacties.
Voorbeeld:
* Groep 1 (Alkali metalen): Alle alkali -metalen hebben één valentie -elektron. Ze verliezen dit elektron gemakkelijk om een +1 ion te vormen, wat leidt tot vergelijkbare reactiviteit in reacties. Ze reageren bijvoorbeeld allemaal krachtig met water om waterstofgas te produceren.
* Groep 17 (halogenen): Alle halogenen hebben zeven valentie -elektronen. Ze krijgen gemakkelijk één elektron om een -1 ion te vormen, waardoor ze zeer reactief zijn. Ze reageren bijvoorbeeld allemaal met metalen om zouten te vormen.
Uitzonderingen:
Hoewel elementen in dezelfde familie overeenkomsten delen, zijn er enkele uitzonderingen vanwege:
* Atomaire maat: Elementen verderop een gezin hebben grotere atoomstralen. Dit kan hun reactiviteit beïnvloeden, waardoor ze reactiever worden.
* elektronegativiteit: Elektronegativiteit, de neiging om elektronen aan te trekken, varieert binnen een gezin. Dit kan bindtypen en reactiviteit beïnvloeden.
Samenvattend: De gelijkenis in chemisch gedrag binnen een gezin is voornamelijk te wijten aan hetzelfde aantal valentie -elektronen, wat hun binding en reactiviteit dicteert. Andere factoren zoals atomaire grootte en elektronegativiteit kunnen echter variaties introduceren.
 Opbreken (eiwitcomplexen) is moeilijk te doen, maar nieuwe studie laat zien hoe
Opbreken (eiwitcomplexen) is moeilijk te doen, maar nieuwe studie laat zien hoe Waarom is argon zeer stabiel en niet reactief?
Waarom is argon zeer stabiel en niet reactief?  Beeldvormingstechniek toont moleculaire machines aan het werk
Beeldvormingstechniek toont moleculaire machines aan het werk Delen van het periodiek systeem
Delen van het periodiek systeem  Metaal-organische raamwerken ontrafelen mechanisme voor het opvangen van water uit de lucht
Metaal-organische raamwerken ontrafelen mechanisme voor het opvangen van water uit de lucht
 Maak onze bodem weer mooi
Maak onze bodem weer mooi Scholen gingen dicht en er werden waarschuwingen uitgegeven nu Azië broeit door een extreme hittegolf
Scholen gingen dicht en er werden waarschuwingen uitgegeven nu Azië broeit door een extreme hittegolf  Orkaan Olaf treft Mexico's Los Cabos resorts in categorie 2
Orkaan Olaf treft Mexico's Los Cabos resorts in categorie 2 Hoe Caterpillar schrankladers en multi-terrain werken
Hoe Caterpillar schrankladers en multi-terrain werken  Nieuw onderzoek werpt licht op waarom sommige dieren naar de donkere, diepe zee duiken
Nieuw onderzoek werpt licht op waarom sommige dieren naar de donkere, diepe zee duiken
Hoofdlijnen
- Wat is het belang van enzymen in een biologisch proces?
- castratie van huisdieren vallen af tijdens pandemie, wat leidt tot overbevolking van opvangcentra
- Leg uit hoe enery en voedingsstoffen binnenkomen, verplaats een voedselketen in een ecosysteem?
- Hoe hybride plantenrassen de uitdagingen van voedselzekerheid en klimaatverandering kunnen aanpakken
- Hoeveel chromosomen zitten er in een bodycel van Carps?
- Europa's oudste boom groeit nog steeds
- Kunnen milieutoxines de biologische 'klok' verstoren?
- Het geheime leven van eilanddieren
- Supermensen creëren door middel van genmanipulatie en meer
- Zeewaterbacteriën bieden aanknopingspunten om melanoom te bestrijden
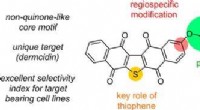
- Onderzoekers onderzoeken mogelijke behandeling voor mitochondriale ziekten
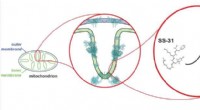
- Eerste 3D-geprinte proton-geleidende membraan effent de weg voor op maat gemaakte energieopslagapparaten

- 3D-printen creëert superzachte structuren die hersenen en longen nabootsen
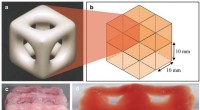
- Ultradunne zelfherstellende polymeren creëren nieuwe, duurzame waterafstotende coatings
 Onderzoekers melden snellere screening van fotobescherming in gewassen
Onderzoekers melden snellere screening van fotobescherming in gewassen Wetenschapper onderzoekt het gebruik van nanodeeltjes om diepgewortelde tumoren te verkleinen
Wetenschapper onderzoekt het gebruik van nanodeeltjes om diepgewortelde tumoren te verkleinen Wat is de polariteit van xanthophylen?
Wat is de polariteit van xanthophylen?  Glad als het nat is:hoe werkt smering?
Glad als het nat is:hoe werkt smering? Hoe hebben gegevens verzameld met behulp van vroege telescoop het helioentrische model?
Hoe hebben gegevens verzameld met behulp van vroege telescoop het helioentrische model?  Porsche-werknemers krijgen bonussen van bijna 10, 000 euro
Porsche-werknemers krijgen bonussen van bijna 10, 000 euro Wat is de naam voor wanneer zwaartekrachten een object in de ruimte in evenwicht zijn?
Wat is de naam voor wanneer zwaartekrachten een object in de ruimte in evenwicht zijn?  Hoe kaviaar werkt
Hoe kaviaar werkt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

