
Wetenschap
Hoe zal de temperatuur de druk en het volume van een gas beïnvloeden?
1. De wet van Gay-Lussac:
* relatie: Deze wet stelt dat bij constant volume de druk van een gas recht evenredig is met zijn absolute temperatuur.
* Verklaring: Naarmate de temperatuur toeneemt, bewegen de gasmoleculen sneller en botsen vaker met de wanden van de container, wat resulteert in verhoogde druk.
2. De wet van Charles:
* relatie: Bij constante druk is het volume van een gas recht evenredig met zijn absolute temperatuur.
* Verklaring: Wanneer de temperatuur toeneemt, krijgen de gasmoleculen kinetische energie en breiden ze uit, wat leidt tot een toename van het volume.
3. Gecombineerde gaswet:
* relatie: Deze wet combineert de wetten van Gay-Lussac en Charles en verklaart dat de verhouding van het product van druk en volume tot de absolute temperatuur constant blijft voor een vaste hoeveelheid gas.
* Vergelijking: (P₁v₁)/t₁ =(p₂v₂)/t₂
* Verklaring: Met deze wet kunt u veranderingen in druk, volume of temperatuur berekenen wanneer twee van de variabelen bekend zijn.
4. Ideale gaswet:
* relatie: Deze wet combineert de hierboven beschreven relaties en introduceert het concept van het aantal mol gas (N).
* Vergelijking: PV =NRT, waarbij r de ideale gasconstante is.
* Verklaring: De ideale gaswet biedt een uitgebreid model voor het begrijpen van het gedrag van gassen onder verschillende omstandigheden.
Samenvattend:
* Verhogende temperatuur: Leidt tot hogere druk (bij constant volume) en een hoger volume (bij constante druk).
* Dalende temperatuur: Leidt tot lagere druk (bij constant volume) en lager volume (bij constante druk).
Belangrijke overwegingen:
* absolute temperatuur: Gaswetten gebruiken absolute temperatuur (Kelvin -schaal), waarbij 0 Kelvin absoluut nul vertegenwoordigt.
* ideaal gas: De gaswetten nemen een ideaal gas aan, wat een theoretisch concept is. Echte gassen wijken af van ideaal gedrag bij hoge drukken en lage temperaturen.
Inzicht in de relatie tussen temperatuur, druk en volume van een gas is essentieel voor veel toepassingen, waaronder:
* Weersvoorspelling: Atmosferische drukveranderingen beïnvloeden de weerpatronen.
* Engineering: Het ontwerpen van systemen met gassen, zoals motoren en compressoren.
* chemie: Het voorspellen van het gedrag van gassen bij chemische reacties.
 Welke van de volgende is het meest waarschijnlijk een gas bij kamertemperatuur CH4 MGO CAF2 FECL3 LIF?
Welke van de volgende is het meest waarschijnlijk een gas bij kamertemperatuur CH4 MGO CAF2 FECL3 LIF?  Wat beïnvloedt zowel de oplossingssnelheid als de oplosbaarheid van een vaste stof in vloeistof?
Wat beïnvloedt zowel de oplossingssnelheid als de oplosbaarheid van een vaste stof in vloeistof?  Hoe verschillen zuren van basis?
Hoe verschillen zuren van basis?  Wat is een vochtscheider van nucleaire reactor?
Wat is een vochtscheider van nucleaire reactor?  Welk gas ontstaat wanneer aluminium reageert met natriumhydroxide?
Welk gas ontstaat wanneer aluminium reageert met natriumhydroxide?
 Nederlands dorp uit voorzorg geëvacueerd vanwege natuurbrandrook
Nederlands dorp uit voorzorg geëvacueerd vanwege natuurbrandrook Toekomstige overstromingen van de Brahmaputra-rivier als klimaatveranderingen kunnen worden onderschat, studie zegt:
Toekomstige overstromingen van de Brahmaputra-rivier als klimaatveranderingen kunnen worden onderschat, studie zegt: Wat zijn de intermoleculaire aantrekkingskrachten binnen pentaan?
Wat zijn de intermoleculaire aantrekkingskrachten binnen pentaan?  Koude lucht stijgt op - wat dat betekent voor het klimaat op aarde
Koude lucht stijgt op - wat dat betekent voor het klimaat op aarde Ring of Fire-vulkanen herinneren Azië aan seismisch gevaar
Ring of Fire-vulkanen herinneren Azië aan seismisch gevaar
Hoofdlijnen
- Zal een zeester kokkels kunnen eten zonder de buisvoeten te gebruiken. Uitleggen?
- Wat is informatie die paleontologen hebben verzameld?
- Uit onderzoek blijkt dat bedwantsen potentieel gevaarlijke hoeveelheden histamine produceren
- Zeeleeuwen hebben unieke snorharen waarmee ze zelfs de snelste vis kunnen vangen
- Praat je tegen mij? Wetenschappers proberen het mysterie van 'dierlijke gesprekken' te ontrafelen
- Kunnen honden de bron zijn van een nieuwe griep?
- Waarom zou de praktijk van gordelling ervoor zorgen dat boom sterft?
- Wat is anatomische en klinische wortel?
- Waarom is het belangrijk dat wetenschappers hun beperkingen kennen en accepteren?
- Experimentele studie van hoe metallisch glas een uitdaging vormt voor het paradigma in glasonderzoek

- Nieuwe tool is bedoeld om COVID-19 te bestrijden, andere ziekten
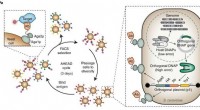
- Een organisch materiaal voor de volgende generatie HVAC-technologieën

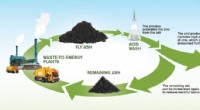
- Kostbaar zink winnen uit afvalas
- Supersterke Al-legeringen kunnen de productieprocessen voor auto's veranderen, ruimtevaartapparatuur

 Waarom het geheime wetenschappelijke voorstel van de EPA de volksgezondheidsexperts alarmeert
Waarom het geheime wetenschappelijke voorstel van de EPA de volksgezondheidsexperts alarmeert Studie onthult oorzaak van 3D-asymmetrie in fusie-implosies van traagheidsopsluiting
Studie onthult oorzaak van 3D-asymmetrie in fusie-implosies van traagheidsopsluiting Wat is de molariteit van 2 mol KI opgelost in 1 liter water?
Wat is de molariteit van 2 mol KI opgelost in 1 liter water?  Hoe een wandeling leidde tot wiskunde 'Eureka!'
Hoe een wandeling leidde tot wiskunde 'Eureka!'  Lessen om te leren, ondanks nog een melding over vermiste vlucht MH370 en nog steeds geen verklaring
Lessen om te leren, ondanks nog een melding over vermiste vlucht MH370 en nog steeds geen verklaring Vormen chloor en zuurstof een ionische verbinding?
Vormen chloor en zuurstof een ionische verbinding?  Wetenschappers verbeteren de akoestische detectieprestaties van gedistribueerde vezels voor seismische detectie op zee
Wetenschappers verbeteren de akoestische detectieprestaties van gedistribueerde vezels voor seismische detectie op zee Cassini bereidt laatste duik in Saturnus voor
Cassini bereidt laatste duik in Saturnus voor
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

