Wetenschap
Waarom zijn watermoleculen samenhangend?
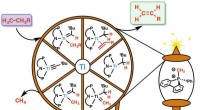
* polariteit: Watermoleculen zijn polair, wat betekent dat ze een enigszins positief uiteinde hebben (de waterstofatomen) en een enigszins negatief uiteinde (het zuurstofatoom). Dit komt door het ongelijke delen van elektronen in het molecuul.
* waterstofbinding: Het positieve uiteinde van het ene watermolecuul (waterstof) wordt aangetrokken door het negatieve uiteinde van een ander watermolecuul (zuurstof). Deze aantrekkingskracht wordt een waterstofbinding genoemd, wat een sterk type intermoleculaire kracht is.
gevolgen van cohesie:
* Hoge oppervlaktespanning: Watermoleculen aan het oppervlak worden sterk aangetrokken tot elkaar, waardoor een hoge oppervlaktespanning ontstaat waarmee insecten op water kunnen lopen.
* Hoog kookpunt: De waterstofbindingen houden watermoleculen bij elkaar, waardoor een aanzienlijke hoeveelheid energie nodig is om deze bindingen te verbreken en water in damp te veranderen.
* Capillaire actie: Watermoleculen worden aangetrokken door de wanden van smalle buizen, waardoor water omhoog kan bewegen tegen de zwaartekracht, zoals te zien in planten.
* Oplosmiddel -eigenschappen: Door de polaire aard van water kan het veel ionische en polaire verbindingen oplossen, waardoor het een uitstekend oplosmiddel is.
Samenvattend is de samenhangende aard van water te wijten aan de sterke waterstofbruggen tussen zijn moleculen. Deze eigenschap heeft belangrijke implicaties voor de fysieke en biologische eigenschappen van water.
 Wat is de oxidatietoestand van SnCl3?
Wat is de oxidatietoestand van SnCl3?  Hoe bemiddelen onderstammen in de zouttolerantie van ent onder zoutstress?
Hoe bemiddelen onderstammen in de zouttolerantie van ent onder zoutstress?  Een nieuw idee verbindt de synthese van klei en de oorsprong van het metabolisme
Een nieuw idee verbindt de synthese van klei en de oorsprong van het metabolisme Voorbeelden van de zuren die dibasisch zijn?
Voorbeelden van de zuren die dibasisch zijn?  100 ml 0,200 moll NaCl wordt gemengd met 400 ml Wat de concentratie CL in resulterende oplossing?
100 ml 0,200 moll NaCl wordt gemengd met 400 ml Wat de concentratie CL in resulterende oplossing?
 Wetenschappers gebruiken oude zeefossielen om al lang bestaande klimaatpuzzel te ontrafelen
Wetenschappers gebruiken oude zeefossielen om al lang bestaande klimaatpuzzel te ontrafelen Kenmerken van een bosecosysteem
Kenmerken van een bosecosysteem  Dalende niveaus van luchtvervuiling zorgden voor afname in Californische tule-mist
Dalende niveaus van luchtvervuiling zorgden voor afname in Californische tule-mist Een appel die uit een boom viel, hielp Sir Isaac Newton met wat te bedenken?
Een appel die uit een boom viel, hielp Sir Isaac Newton met wat te bedenken?  Wat zit er in de mysterieuze wateren van Tulare Lake? Verontreinigingen, zilverreigers en veel onbekenden
Wat zit er in de mysterieuze wateren van Tulare Lake? Verontreinigingen, zilverreigers en veel onbekenden
Hoofdlijnen
- Welke vooruitgang in de biotechnologie heeft de mensheid geprofiteerd door een DNA -catalogus te bieden voor verdere onderzoeksgenetica en ziektepreventie?
- Welk proces vindt plaats in de cellen van Spirulina dat niet bij de mens voorkomt?
- Organel dat water uit de cel pompt?
- Hoe gebruiken wetenschappers dichtheid in hun vakgebied?
- Wat is totaal RNA?
- Bacteriën die nuttig zijn voor het ecosysteem?
- Waarom wordt pseudowetenschap niet beschouwd als echte wetenschap?
- Drang om samen te voegen:begrijpen hoe cellen samensmelten
- Reproductieproces bij mensen
 Dynamisch energiebeheersysteem voor het MKB
Dynamisch energiebeheersysteem voor het MKB Waarom lijken de dichtstbijzijnde sterren over en terug te bewegen tegen meer verre sterren?
Waarom lijken de dichtstbijzijnde sterren over en terug te bewegen tegen meer verre sterren?  Planken ontdaan terwijl Irma naar Miami rent
Planken ontdaan terwijl Irma naar Miami rent Hoe is waterstofbinding belangrijk voor het lichaam?
Hoe is waterstofbinding belangrijk voor het lichaam?  Coronavirus:Econoom ziet scherp, kortstondige effecten
Coronavirus:Econoom ziet scherp, kortstondige effecten Wie waar de belangrijkste wetenschappers in Apollo 11?
Wie waar de belangrijkste wetenschappers in Apollo 11?  Wanneer vaste stof wordt opgelost in een vloeistof?
Wanneer vaste stof wordt opgelost in een vloeistof?  Verbetering van de elektrische en mechanische eigenschappen van op koolstof-nanobuis gebaseerde vezels
Verbetering van de elektrische en mechanische eigenschappen van op koolstof-nanobuis gebaseerde vezels
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com