
Wetenschap
Wat zijn vier manieren waarop een atoom bindingen kan vormen met andere atomen?
1. ionische binding: Dit gebeurt wanneer één atoom doneert een elektron naar een ander atoom. Dit resulteert in het ene atoom dat positief wordt geladen (een kation) en het andere negatief geladen worden (een anion). De elektrostatische aantrekkingskracht tussen deze tegengesteld geladen ionen houdt ze bij elkaar.
2. Covalente binding: Bij covalente binding, atomen delen elektronen. Dit delen kan gelijk zijn (niet -polaire covalente binding) of ongelijk (polaire covalente binding), waarbij één atoom een sterkere trek heeft op de gedeelde elektronen. De gedeelde elektronen creëren een sterke aantrekkingskracht tussen de atomen.
3. Metallic binding: Dit type binding vindt alleen plaats tussen metaalatomen. Het gaat om een "zee" van gedelokaliseerde elektronen die niet gebonden zijn aan een bepaald atoom. Met deze zee van elektronen kan metalen elektriciteit en warmte goed leiden en hen hun karakteristieke glans en kneedbaarheid geven.
4. Waterstofbinding: Hoewel geen "echte" binding op dezelfde manier als de andere, is waterstofbinding een sterk type intermoleculaire aantrekkingskracht. Het komt voor tussen een waterstofatoom covalent gebonden aan een sterk elektronegatief atoom (zoals zuurstof, stikstof of fluor) en een eenzaam paar elektronen op een aangrenzend elektronegatief atoom. Deze aantrekkingskracht speelt een cruciale rol in de eigenschappen van water en andere biologische moleculen.
 Wat is de hydroxideconcentratie in 2,7 10 -3 M HCl?
Wat is de hydroxideconcentratie in 2,7 10 -3 M HCl?  Neutronen werpen licht op industriële katalysator voor waterstofproductie
Neutronen werpen licht op industriële katalysator voor waterstofproductie Wat is de moleculaire vergelijking voor ijzernitraat en ammoniumcarbonaat?
Wat is de moleculaire vergelijking voor ijzernitraat en ammoniumcarbonaat?  Universeel regulatiemechanisme in plantencellen ontdekt
Universeel regulatiemechanisme in plantencellen ontdekt Kan er een covalente binding ontstaan wanneer elektronen worden overgedragen tussen 2 atomen?
Kan er een covalente binding ontstaan wanneer elektronen worden overgedragen tussen 2 atomen?
Hoofdlijnen
- Wat is een definitie van basis?
- Wat is Jamais Vu?
- Delen van de menselijke hiel
- Wat is de functie van cytoplasma in een root haarcel?
- Wie bedacht de celtheorie?
- Welke van de volgende kan leiden tot onmiddellijke speciatie?
- In welke richting wordt voedsel overgedragen in een vasculaire plant?
- Waarom chimpansees elkaar aanvallen en doden
- Het verzamelen van levende slangen in afgelegen Amazonegebieden voor onderzoek is geen gemakkelijke taak; dit is hoe we dat doen
- Nieuwe materialen met een hoge zuurstof-ionengeleiding die een duurzame toekomst opent
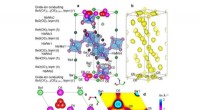
- Neutronen onderzoeken biologische materialen voor inzicht in COVID-19-virusinfectie
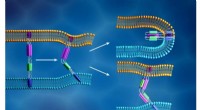
- Een baanbrekende ontdekking in de conversie van koolstofafvang voor de productie van ethyleen

- Generatie van een stabiel biradicaal
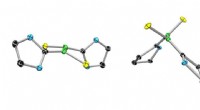
- Nieuwe antibacteriële geneesmiddelen ontwikkeld aan de Universiteit van Oost-Finland
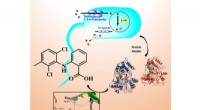
 Begrijpen hoe cellen reageren op nanodeeltjes
Begrijpen hoe cellen reageren op nanodeeltjes Tijdsverschil tussen Parijs en Londen in de zomer?
Tijdsverschil tussen Parijs en Londen in de zomer?  Hoeveel planeten draaien om de zon en Mars?
Hoeveel planeten draaien om de zon en Mars?  Geen voedsel, geen brandstof, geen telefoons:bosbranden toonden aan dat ze slechts één stap verwijderd waren van het instorten van het systeem
Geen voedsel, geen brandstof, geen telefoons:bosbranden toonden aan dat ze slechts één stap verwijderd waren van het instorten van het systeem Aalto-2-satelliet gelanceerd in de ruimte
Aalto-2-satelliet gelanceerd in de ruimte Een metronoom voor kwantumdeeltjes
Een metronoom voor kwantumdeeltjes Hoeveel aardedagen zijn er op Melkweg?
Hoeveel aardedagen zijn er op Melkweg?  De ontwikkeling van taalvaardigheid thuis vereist een sterke motivatie, studie toont
De ontwikkeling van taalvaardigheid thuis vereist een sterke motivatie, studie toont
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

