
Wetenschap
Is oplosbaarheid hetzelfde voor verschillende temperaturen van oplosmiddel?
Dit is waarom:
* Temperatuur en kinetische energie: Temperatuur is een maat voor de gemiddelde kinetische energie van moleculen. Naarmate de temperatuur toeneemt, bewegen moleculen sneller en hebben meer energie.
* Breek intermoleculaire krachten: Voor een opgeloste oplossing moeten de intermoleculaire krachten tussen zijn moleculen (en de oplosmiddelmoleculen) worden verbroken. Verhoogde kinetische energie maakt het gemakkelijker om deze krachten te breken.
* Verhoogde ontbinding: Met verhoogde kinetische energie kunnen meer opgeloste moleculen interageren met de oplosmiddelmoleculen, wat leidt tot een grotere oplosbaarheid.
Algemene trends:
* vaste stoffen: De oplosbaarheid van de meeste vaste stoffen in vloeistoffen neemt toe met de temperatuur. Denk aan suiker die sneller oplost in heet water dan koud water.
* gassen: De oplosbaarheid van gassen in vloeistoffen neemt af met de temperatuur. Stel je voor dat je een fles frisdrank opent. Meer gas ontsnapt (lost minder op) in warm frisdrank dan koude frisdrank.
Uitzonderingen: Er zijn enkele uitzonderingen op deze algemene trends, maar ze komen minder vaak voor.
Samenvattend: Temperatuur speelt een belangrijke rol in oplosbaarheid. Hoe hoger de temperatuur, hoe groter de kans dat een opgeloste stof in een oplosmiddel oplost (met enkele uitzonderingen na).
 Wat is een naam van het mengsel dat vloeibaar is gemaakt?
Wat is een naam van het mengsel dat vloeibaar is gemaakt?  C1 is de chemische stof voor chloor?
C1 is de chemische stof voor chloor?  Waarom is benzine ontvlambaar en water niet, hoewel niet beide vloeistoffen zijn?
Waarom is benzine ontvlambaar en water niet, hoewel niet beide vloeistoffen zijn?  Wetenschappers meten hoe ionen de wanden van fusie-apparaten bombarderen
Wetenschappers meten hoe ionen de wanden van fusie-apparaten bombarderen  Biologen ontdekken carotenoïdenoverdracht tussen twee eiwitten
Biologen ontdekken carotenoïdenoverdracht tussen twee eiwitten
 Biologische afbraak van olie geremd in diepzeesedimenten
Biologische afbraak van olie geremd in diepzeesedimenten Wat beschrijft diversiteit het beste in termen van natuurlijke selectie?
Wat beschrijft diversiteit het beste in termen van natuurlijke selectie?  Twee NASA-satellieten bevestigen de zwaarste neerslagverschuiving van tropische cycloon Ampils
Twee NASA-satellieten bevestigen de zwaarste neerslagverschuiving van tropische cycloon Ampils Portugese brandweerlieden brengen bosbranden onder controle
Portugese brandweerlieden brengen bosbranden onder controle Aquaria:Jordan laat militaire hardware zinken voor onderwatermuseum
Aquaria:Jordan laat militaire hardware zinken voor onderwatermuseum
Hoofdlijnen
- Oorlog verstoort de natuur permanent, studie vondsten
- Onderzoekers ontdekken een nieuwe laag genetische informatie die helpt bepalen hoe snel eiwitten worden geproduceerd
- Kan koraal onze oceanen redden? Onderzoekers ontdekken dat zacht weefsel riffen kan helpen beschermen
- Plantenveredeling:onzichtbare chromosomen gebruiken om pakketjes positieve eigenschappen door te geven
- Wat is met plant geassocieerde schimmels?
- Wat is de unieke rol van een organisme?
- Kunnen stereotypen worden gekwantificeerd?
- Wat termieten en cellen gemeen hebben
- Proteomische analyse laat zien hoe fosfiet bijdraagt aan de strijd tegen chemisch resistente afsterving
- DNA-suikers gekenmerkt in ongekende resolutie, atoom voor atoom
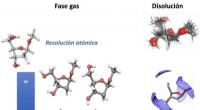
- Kan citroenzuur een groen alternatief zijn voor het beschermen van staal?

- Het beste van twee werelden:twee skeletvormende chemische reacties combineren
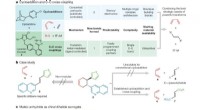
- Wetenschappers ontwikkelen goedkope chip om aanwezigheid en hoeveelheid COVID-19-antilichamen te detecteren

- Plantaardige verbinding zou een sleutelrol kunnen spelen bij het bestrijden van de ziekte van Alzheimer

 Eenvoudige maatregelen kunnen een grote bijdrage leveren aan de bestrijding van luchtvervuiling op scholen, zeggen experts
Eenvoudige maatregelen kunnen een grote bijdrage leveren aan de bestrijding van luchtvervuiling op scholen, zeggen experts Waarom hebben we schrikkeljaren nodig? Astrofysici verklaren de extra datum van deze maand
Waarom hebben we schrikkeljaren nodig? Astrofysici verklaren de extra datum van deze maand  De weg naar infrarooddetectie verlichten
De weg naar infrarooddetectie verlichten Nieuw onderzoek werpt licht op hoe oude wijn zijn aroma krijgt
Nieuw onderzoek werpt licht op hoe oude wijn zijn aroma krijgt  Dreigende dood voor papieren coupons?
Dreigende dood voor papieren coupons?  Waarom is vulkanische asmagetisch?
Waarom is vulkanische asmagetisch?  Hoe word je een geweldige bedrieger?
Hoe word je een geweldige bedrieger? Virgin Galactic zegt dat FAA het heeft goedgekeurd voor verdere vluchten
Virgin Galactic zegt dat FAA het heeft goedgekeurd voor verdere vluchten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

