
Wetenschap
Waarom wordt de temperatuur constant op het kookpunt van vloeistof?
Hier is een uitsplitsing:
1. Energie -input: Wanneer je een vloeistof verwarmt, voeg je energie toe aan zijn moleculen. Deze energie verhoogt hun kinetische energie, waardoor ze sneller bewegen en meer trillen.
2. Intermoleculaire krachten overwinnen: Naarmate de temperatuur stijgt, krijgen de moleculen voldoende energie om de aantrekkelijke krachten te overwinnen (zoals waterstofbinding, dipool-dipoolinteracties of Londense dispersiekrachten) die ze in de vloeibare toestand bij elkaar houden.
3. Faseverandering: Op het kookpunt hebben de moleculen voldoende energie om volledig los te komen van hun vloeibare buren en te ontsnappen in de dampfase. Deze faseverandering vereist een aanzienlijke hoeveelheid energie, de verdampingswarmte genoemd .
4. Constante temperatuur: De energie die u blijft input worden gebruikt om meer bindingen te verbreken en meer moleculen te verdampen, in plaats van de kinetische energie van de resterende vloeibare moleculen te vergroten. Daarom blijft de temperatuur constant totdat alle vloeistof in damp is omgezet.
In wezen wordt de op het kookpunt geleverde energie volledig geconsumeerd in het proces van het overwinnen van intermoleculaire krachten en het veranderen van de toestand van materie, in plaats van de temperatuur te verhogen. Daarom blijft de temperatuur constant tijdens het koken, hoewel er nog steeds warmte aan het systeem wordt toegevoegd.
 Wat begrijp ik van omgevingsomstandigheden en de ervaringen waarvan bekend is dat ze positieve effecten hebben op de prenatale vroege kinderjaren?
Wat begrijp ik van omgevingsomstandigheden en de ervaringen waarvan bekend is dat ze positieve effecten hebben op de prenatale vroege kinderjaren?  Onderzoekers reconstrueren de seizoensgebondenheid van neerslag in centraal China in de afgelopen eeuw
Onderzoekers reconstrueren de seizoensgebondenheid van neerslag in centraal China in de afgelopen eeuw De wereld redden met vissticks
De wereld redden met vissticks Onderzoekers onthullen grootste en heetste schildvulkaan op aarde
Onderzoekers onthullen grootste en heetste schildvulkaan op aarde Vernietigen waterscooters de planeet?
Vernietigen waterscooters de planeet?
Hoofdlijnen
- Het magische medicijn van Bezoars
- Wildfire vormt een grotere bedreiging voor cannabis dan andere Californische gewassen
- Sluwe kraaien weten wat er nodig is om een goed stuk gereedschap te maken
- Wat is het enzymatische mechanisme voor RNA -splitsing?
- Wat wordt bedoeld met fenotype plasticiteit in wortels en scheuten?
- Hoe zijn fotosynthese en cellulaire ademhaling gerelateerd
- Wat het genoom van de longvissen ons leert over de verovering van land door gewervelde dieren
- Enzymcomplexen die eiwitten afbreken heten?
- Waarom het coronavirus de bedreigde diersoorten in China kan helpen redden
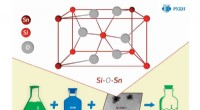
- Een herbruikbare katalysator voor de synthese van esters
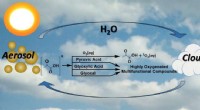
- Organische 2-oxocarbonzuren zorgen voor een link naar de vorming van radicalen en reactieve zuurstofsoorten in atmosferische deeltjes
- Vervaardiging van metaal-organische framegebaseerde composieten voor efficiëntie

- Minder duur produceren, groenere waterstofperoxide
- De milieukosten van contactlenzen

 Lesgeven in CRISPR en antibioticaresistentie aan middelbare scholieren
Lesgeven in CRISPR en antibioticaresistentie aan middelbare scholieren Is ijzeroxide een mengsel of verbinding?
Is ijzeroxide een mengsel of verbinding?  Welke ionen worden geproduceerd als KCl oplost in H2O?
Welke ionen worden geproduceerd als KCl oplost in H2O?  Wat is de naam van vulkaan die minoïs heeft vernietigd?
Wat is de naam van vulkaan die minoïs heeft vernietigd?  ADB waarschuwt dat klimaatverandering rampzalig is voor Azië
ADB waarschuwt dat klimaatverandering rampzalig is voor Azië Een vormgeheugenpolymeer gebruiken als robotgrijper
Een vormgeheugenpolymeer gebruiken als robotgrijper Kwantitatieve reconstructie van paleodruk in formaties en casestudies
Kwantitatieve reconstructie van paleodruk in formaties en casestudies Wat beschrijft Electron Orbital?
Wat beschrijft Electron Orbital?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

