
Wetenschap
Wat beschrijft Electron Orbital?
Hier is een uitsplitsing:
* Dualiteit van golfdeeltjes: Elektronen vertonen zowel golf- als deeltjeseigenschappen. Hun golfkarakter wordt beschreven door een golffunctie, die de kans bepaalt om het elektron op een specifieke locatie te vinden.
* waarschijnlijkheidsverdeling: Een elektronenorbitaal vertegenwoordigt een regio waar een grote kans is om het elektron te vinden. Het is geen solide, gedefinieerde grens.
* Vorm en energie: Orbitalen hebben verschillende vormen (S, P, D, F) en energieniveaus. De vorm weerspiegelt de verdeling van de golffunctie van het elektron in de ruimte en het energieniveau bepaalt zijn energie.
* Quantumnummers: Elk orbitaal wordt gedefinieerd door een set van vier kwantumnummers (n, l, m l , m s ) die de energie, vorm, ruimtelijke oriëntatie en spin van het elektron beschrijven.
In essentie is een elektronenorbitaal een model dat ons helpt het gedrag van elektronen in een atoom te begrijpen, hoewel we hun bewegingen niet precies kunnen volgen.
Hier is een analogie:stel je voor dat je een flikkerende gloeilamp hebt. Je kunt de lichte deeltjes (fotonen) zelf niet zien, maar je kunt de intensiteit van het licht observeren en de gebieden die het verlicht. Evenzo kunnen we geen elektronen zien, maar we kunnen orbitalen gebruiken om hun waarschijnlijke locatie en energieniveaus te begrijpen.
 Vlieg meer, minder vervuilen - het grote luchtvaartraadsel
Vlieg meer, minder vervuilen - het grote luchtvaartraadsel Wetenschappers ontwikkelen groenere kunststoffen - de grotere uitdaging is om ze van het laboratorium naar de markt te brengen
Wetenschappers ontwikkelen groenere kunststoffen - de grotere uitdaging is om ze van het laboratorium naar de markt te brengen Veerkracht, niet ineenstorting:wat de Paaseiland-mythe verkeerd doet
Veerkracht, niet ineenstorting:wat de Paaseiland-mythe verkeerd doet  Secundaire bossen bieden ontbossingsbuffer voor oerbossen
Secundaire bossen bieden ontbossingsbuffer voor oerbossen Wetenschappers racen om het kusterfgoed van Puerto Rico te documenteren
Wetenschappers racen om het kusterfgoed van Puerto Rico te documenteren
Hoofdlijnen
- Wat zijn de verschillen tussen PCR en klonen?
- Wat is een onopvallende milt?
- Wat is een palindroom in relatie tot de restrictie-enzymplaats?
- Wat is het transport van een molecuul van binnenuit cel tot buiten genoemd?
- Hoeveel organen in totaal heeft een vrouw?
- Wat het verschil tussen RNA en DNA in aantal strengen?
- Laboratoriumtests tonen aan dat het molecuul de celdood in tumoren en ontstekingen lijkt te stimuleren
- De verzorgingsgewoonten van apen geven aanwijzingen over hoe we met elkaar omgaan
- Wat transcribeert mRNA?
- Er komt iets slecht (ruikend) op deze manier - de wetenschap van stoffen en geuren

- Het meten van ethanol dodelijke tweeling

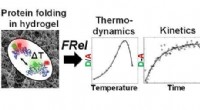
- Onderzoek naar vouwstabiliteit en dynamiek van eiwitten
- Efficiënte en duurzame materialen voor perovskiet-zonnecellen

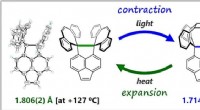
- Covalente koolstof-koolstofbindingen veel flexibeler dan verondersteld
 Welke speekselklier produceert een sereuze secretie die grote hoeveelheden amylase bevat?
Welke speekselklier produceert een sereuze secretie die grote hoeveelheden amylase bevat?  Wat zijn de voor- en nadelen van klimaatverandering?
Wat zijn de voor- en nadelen van klimaatverandering?  Wat is de definitie van perculatie?
Wat is de definitie van perculatie?  Wetenschappers duiken diep in de imperfecte wereld van 2D-materialen
Wetenschappers duiken diep in de imperfecte wereld van 2D-materialen Egypte plaatst kolos van Ramses II in atrium van nieuw museum (Update)
Egypte plaatst kolos van Ramses II in atrium van nieuw museum (Update) Ontsnap aan de dampen:wetenschappers roepen op tot een mondiale verschuiving om het consumentengebruik van wegwerptechnologieën te beteugelen
Ontsnap aan de dampen:wetenschappers roepen op tot een mondiale verschuiving om het consumentengebruik van wegwerptechnologieën te beteugelen  Waar is een lopend vuurtje gevonden?
Waar is een lopend vuurtje gevonden?  Wat is een gemiddelde lichaamstemperatuur?
Wat is een gemiddelde lichaamstemperatuur?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

