
Wetenschap
Waarom heeft het triethylamine -watersysteem een lagere consolute temperatuur?
1. Waterstofbinding:
* Water: Watermoleculen zijn zeer polair en vormen sterke waterstofbruggen met elkaar.
* triethylamine: Triethylamine is een niet-polair molecuul en vormt geen waterstofbruggen met water.
2. Entropie en enthalpie:
* Lage temperaturen: Bij lage temperaturen wordt de voorkeur gegeven aan de entropiewinst van het mengen. Dit betekent dat het systeem een meer ongeordende toestand bevordert met beide opgeloste componenten.
* Hoge temperaturen: Naarmate de temperatuur toeneemt, wordt de enthalpie -term dominanter. De ongunstige interacties tussen water en triethylamine worden meer uitgesproken, wat leidt tot fasescheiding.
3. Hydrofobe effecten:
* Triethylamine is een hydrofoob molecuul, wat betekent dat het water afstoot. Bij hogere temperaturen wordt het hydrofobe effect sterker, waardoor de triethylaminemoleculen samen clusteren, scheidend van de waterfase.
4. Moleculaire grootte en vorm:
* Triethylamine is een relatief groot molecuul met een omvangrijke structuur. Dit verschil in grootte en vorm tussen triethylamine en watermoleculen draagt bij aan de ongunstige interacties bij hogere temperaturen.
Samenvattend:
De lagere consolute temperatuur in het triethylamine-watersysteem komt voort uit het samenspel tussen waterstofbinding, entropie, enthalpie, hydrofobe effecten en verschillen in moleculaire grootte en vorm. Bij lage temperaturen weegt de entropiewinst van het mengen op tegen de ongunstige interacties, wat leidt tot mengbaarheid. Naarmate de temperatuur toeneemt, worden de ongunstige interacties dominanter, wat resulteert in fasescheiding en een lagere consolute temperatuur.
 Welk effect heeft bomen op de bodem?
Welk effect heeft bomen op de bodem?  Studie laat zien hoe permafrost methaan afgeeft in het opwarmende Noordpoolgebied
Studie laat zien hoe permafrost methaan afgeeft in het opwarmende Noordpoolgebied Waarom is het geleidelijke verlies van regenwouden een belangrijke zorg voor het milieu?
Waarom is het geleidelijke verlies van regenwouden een belangrijke zorg voor het milieu?  Nieuwe innovatieve statistische tool verbetert de bestrijding van vervuiling in steden
Nieuwe innovatieve statistische tool verbetert de bestrijding van vervuiling in steden Wat zijn oliezanden?
Wat zijn oliezanden?
Hoofdlijnen
- Een groep gespecialiseerde cellen vormt eerst een?
- Hoe evolueren bacteriën in de darmen in de loop van een jaar?
- Wat is de urine -pH bij een uitgedroogde persoon?
- Welke sierplanten presteren het beste voor bestuivers?
- Wat zijn de drie soorten koolhydraten en wat gebruikt er?
- Evolutionair gewasonderzoek:Egoplanten geven lagere opbrengst
- Wetenschappelijke naam voor een geslachtscel?
- Stambomen van bloedcellen geven aan hoe de productie verandert naarmate we ouder worden
- Wat is chromosomale theorie?
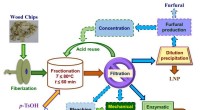
- Delignificatie van houtmonsters met p-tolueensulfonzuur als recyclebare hydrotroop
- Baanbrekende forensische aanpak om de verkoop van nepdrugs aan te pakken
- Vervaardiging van aluminiumlegeringen nu 50% energiezuiniger

- Video:Waarom chemici marcheerden voor wetenschap

- Waardoor smaakt en ruikt de Appalachian truffel heerlijk?

 Geminiaturiseerde robots kunnen door biologische vloeistoffen worden voortgedreven door een enzymatische reactie of ultrageluid
Geminiaturiseerde robots kunnen door biologische vloeistoffen worden voortgedreven door een enzymatische reactie of ultrageluid UVB-straling beïnvloedt het gedrag van stekelbaarzen
UVB-straling beïnvloedt het gedrag van stekelbaarzen Een blik op de veranderingen van Facebook door de jaren heen in wat je ziet
Een blik op de veranderingen van Facebook door de jaren heen in wat je ziet  Wetenschappers ontdekken kleinste supergeleider ter wereld
Wetenschappers ontdekken kleinste supergeleider ter wereld Pesten, racisme en anders zijn:waarom sommige gezinnen kiezen voor leren op afstand, ongeacht COVID-19
Pesten, racisme en anders zijn:waarom sommige gezinnen kiezen voor leren op afstand, ongeacht COVID-19 Hoe de Ti-30Xa Texas Instruments Calculator te gebruiken
Hoe de Ti-30Xa Texas Instruments Calculator te gebruiken GM ziet hogere winst in 2019 op banenverlies, solide VS, Chinese verkoop
GM ziet hogere winst in 2019 op banenverlies, solide VS, Chinese verkoop Hoe werken chemici in het laboratorium?
Hoe werken chemici in het laboratorium?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

