
Wetenschap
Waarom hebben alle elementen in een groep vergelijkbare fysische en chemische eigenschappen?
Dit is waarom:
* valentie -elektronen: Dit zijn de elektronen in de buitenste schaal van een atoom. Zij zijn degenen die betrokken zijn bij chemische binding en reacties.
* Vergelijkbare reactiviteit: Elementen in dezelfde groep hebben hetzelfde aantal valentie -elektronen, wat betekent dat ze de neiging hebben om op een vergelijkbare manier elektronen te winnen, verliezen of delen. Dit resulteert in vergelijkbare reactiviteit en chemisch gedrag.
* Vergelijkbare binding: Elementen in dezelfde groep vormen vergelijkbare soorten bindingen (bijv. Ionisch, covalent). Alle elementen in groep 1 (alkali -metalen) hebben bijvoorbeeld de neiging om één elektron te verliezen en +1 ionen te vormen.
* Vergelijkbare fysieke eigenschappen: Hoewel niet altijd zo direct als chemische eigenschappen, kan het aantal valentie -elektronen ook de fysische eigenschappen beïnvloeden, zoals smeltpunt, kookpunt en dichtheid.
Voorbeeld:
* Groep 1 (Alkali metalen): Lithium (Li), natrium (NA), kalium (K), rubidium (RB), cesium (CS) en Francium (FR) hebben allemaal één valentie -elektron. Dit leidt tot vergelijkbare reactiviteit (gemakkelijk reageren met water) en fysische eigenschappen (zachte, zilverachtige metalen met lage smeltpunten).
Samenvattend:
De gelijkenis in het aantal valentie -elektronen tussen elementen in een groep leidt tot vergelijkbare chemische binding, reactiviteit en bijgevolg vergelijkbare fysische en chemische eigenschappen.
 Zeta knalt in het zuiden van de VS, gedegradeerd tot tropische storm (update)
Zeta knalt in het zuiden van de VS, gedegradeerd tot tropische storm (update) How Do Peacocks Mate?
How Do Peacocks Mate?  Onderzoek suggereert dat vlees- en zuivelindustrie op schema ligt om oliemaatschappijen te overtreffen als grootste uitstoters van broeikasgassen
Onderzoek suggereert dat vlees- en zuivelindustrie op schema ligt om oliemaatschappijen te overtreffen als grootste uitstoters van broeikasgassen Kunnen schimmels de grassen van Texas helpen omgaan met de klimaatverandering?
Kunnen schimmels de grassen van Texas helpen omgaan met de klimaatverandering?  6 stappen over hoe wolken worden gevormd
6 stappen over hoe wolken worden gevormd
Hoofdlijnen
- Wat is de erfgenaam van materie?
- Wat is een soort reproductie van nakomelingen?
- Rol van sucrose in DNA -isolatie uit menselijk bloed?
- Wat betekent het als ze zeggen dat massa in een mengsel wordt behouden?
- Welke drie dingen helpen bloed door aderen te duwen?
- Wat is het eindproduct van mitochondriën?
- Wat zijn de kenmerken van een homozygoot fenotype?
- Welke systemen maken het voor een mens mogelijk om te schrijven en hoe?
- Wat is de functie en het gebruik van stikstof in uw lichaam?
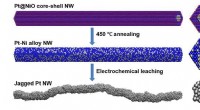
- Ruwe oppervlakken bieden extra locaties voor energieopwekkende reacties in brandstofcellen
- Sorghum:gezonde voeding, zoetstof en nu, kleding kleurstof

- Nieuw metaal-organisch raamwerk kan giftig zwaveldioxidegas opnemen

- Warmtegeleidend plastic kan leiden tot lichtere elektronica, auto's

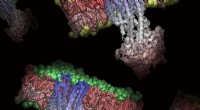
- Nieuw inzicht in celmembranen kan het testen en ontwerpen van geneesmiddelen verbeteren
 De Prosecco-heuvels van Italië staan op de UNESCO Werelderfgoedlijst
De Prosecco-heuvels van Italië staan op de UNESCO Werelderfgoedlijst Hoe brassinosteroïde-signalering ervoor zorgt dat wortels langer groeien bij stikstofgebrek
Hoe brassinosteroïde-signalering ervoor zorgt dat wortels langer groeien bij stikstofgebrek  Wat is de afstand van Sirius tot aarde?
Wat is de afstand van Sirius tot aarde?  Onderzoeksintensieve universiteiten in Afrika? Een model om ze te bouwen
Onderzoeksintensieve universiteiten in Afrika? Een model om ze te bouwen Wat kan er gebeuren als verschillende luchtmassa's in contact met elkaar komen over de Great Plains?
Wat kan er gebeuren als verschillende luchtmassa's in contact met elkaar komen over de Great Plains?  Ruimte-indringers:Radiata-dennen verspreiden zich meer in NZ dan eerder werd gedacht
Ruimte-indringers:Radiata-dennen verspreiden zich meer in NZ dan eerder werd gedacht Zuid-Chinese Zee blijkt verhoogde niveaus van antropogene oppervlaktestikstof te hebben
Zuid-Chinese Zee blijkt verhoogde niveaus van antropogene oppervlaktestikstof te hebben Welk edelgas heeft de laagste ionisatie -energie?
Welk edelgas heeft de laagste ionisatie -energie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

