
Wetenschap
Moleculaire rangschikking van vast vloeibaar gas?
vaste stoffen
* sterk geordend: Moleculen zijn strak verpakt en gerangschikt in een regelmatig, herhaaldelijk patroon dat een kristalrooster wordt genoemd.
* Sterke intermoleculaire krachten: De moleculen worden bij elkaar gehouden door sterke intermoleculaire krachten (zoals ionische bindingen, covalente bindingen of metalen bindingen). Dit houdt ze in een vaste positie.
* Vaste vorm en volume: Vaste stoffen behouden hun vorm en volume. Ze zijn niet samendrukbaar vanwege de nauwe verpakking van moleculen.
vloeistoffen
* minder geordend: Moleculen zijn dichter bij elkaar dan in gassen, maar hebben meer bewegingsvrijheid dan in vaste stoffen. Ze kunnen langs elkaar glijden.
* Matige intermoleculaire krachten: Intermoleculaire krachten zijn zwakker dan in vaste stoffen, maar nog steeds significant genoeg om moleculen relatief dicht bij elkaar te houden.
* vast volume, variabele vorm: Vloeistoffen behouden een constant volume maar nemen de vorm van hun container. Ze zijn enigszins samendrukbaar.
gassen
* Geen vaste regeling: Moleculen zijn ver uit elkaar en bewegen vrij in willekeurige richtingen met hoge kinetische energie.
* Zwakke intermoleculaire krachten: Intermoleculaire krachten zijn erg zwak, waardoor een significante scheiding tussen moleculen mogelijk is.
* Variabele vorm en volume: Gassen vullen de hele container waarin ze zich bevinden. Ze zijn zeer samendrukbaar vanwege de grote ruimtes tussen moleculen.
Visuele analogie
Stel je een groep mensen voor:
* solide: Mensen staan in een strakke, ordelijke lijn, niet in staat om veel te bewegen.
* vloeistof: Mensen in een drukke kamer, in staat zich te bewegen en tegen elkaar te botsen, maar nog steeds relatief dichtbij.
* gas: Mensen verspreidden zich over een groot veld en bewegen vrij en zelden interactie.
Key Takeaways
* De opstelling van moleculen bepaalt de toestand van materie.
* De sterkte van intermoleculaire krachten speelt een sleutelrol bij het bepalen van hoe strak gepakte moleculen zijn en hoeveel ze kunnen bewegen.
* Temperatuur beïnvloedt de beweging van moleculen, die overgangen tussen toestanden kunnen veroorzaken (zoals smelten of koken).
 Klimaatverandering:dit is het moment om beter te herbouwen
Klimaatverandering:dit is het moment om beter te herbouwen Onderzoekers bevestigen dat de binnenkern van de aarde solide is
Onderzoekers bevestigen dat de binnenkern van de aarde solide is Orkaan Michael krijgt een upgrade naar de zeldzame categorie 5-status
Orkaan Michael krijgt een upgrade naar de zeldzame categorie 5-status De echte mislukking van de klimaatconferenties in Madrid was het niet krijgen van een brede deal over de wereldwijde koolstofmarkten
De echte mislukking van de klimaatconferenties in Madrid was het niet krijgen van een brede deal over de wereldwijde koolstofmarkten Overschakelen naar een thuisbatterij zal de wereld niet redden van klimaatverandering
Overschakelen naar een thuisbatterij zal de wereld niet redden van klimaatverandering
Hoofdlijnen
- Hoe Nigeria zijn enorme cashew-afval kan omzetten in waardevol citroenzuur
- De reden voor het kleuren van een exemplaar op de microscoop
- Wat is bijvoorbeeld een regulerend voedsel?
- Kun jij een slak laten vergeten?
- Wat is de functie van een eicel?
- Welk type weefsel bevat cellen die neuronen worden genoemd?
- Eekhoorns en hamsters die in winterslaap zijn, zijn geëvolueerd om het minder koud te hebben
- Bieden planten voedsel voor elk type heterotrofen?
- Australische hagedissen eisen tol van schildpadeieren
- Een stap dichter bij praktische zonne-waterstofproductie via uitgebreid gemodificeerde hematiet-fotoanode
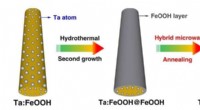
- Video:Hoe de houdbaarheidsdatum van medicijnen werkt

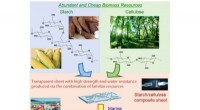
- Onderzoekers maken in water afbreekbaar plastic dat zetmeel en cellulose combineert
- Glas en de energiehervorming:duurzame productie dankzij elektriciteit?

- De opwindende chemie van naderbij bekijken

 Natuurkundige stelt manier voor om sluitertijden van camera's die moleculen waarnemen vast te leggen
Natuurkundige stelt manier voor om sluitertijden van camera's die moleculen waarnemen vast te leggen Crowdfunding uit de pandemie komt vaker voor, succesvol in welvarende gemeenschappen
Crowdfunding uit de pandemie komt vaker voor, succesvol in welvarende gemeenschappen Een steen met een gewicht van 98 newton wordt 50 meter boven de grond van de rand van een brug geduwd. Wat was de kinetische energie halverwege de val?
Een steen met een gewicht van 98 newton wordt 50 meter boven de grond van de rand van een brug geduwd. Wat was de kinetische energie halverwege de val?  Feiten over convectiestromen
Feiten over convectiestromen Hoe te verdelen met tweecijferige delers
Hoe te verdelen met tweecijferige delers Vier benaderingen om disfunctioneel overleg te begrijpen en te overstijgen
Vier benaderingen om disfunctioneel overleg te begrijpen en te overstijgen Waarom zien verre sterrenstelsels er rood uit?
Waarom zien verre sterrenstelsels er rood uit?  Wat is de dampdruk van CH3OOH?
Wat is de dampdruk van CH3OOH?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

