
Wetenschap
Welk type stof kan elektriciteit in de vloeistof leiden maar niet vaste fase?
Dit is waarom:
* elektrolyten zijn stoffen die ionen (geladen deeltjes) bevatten die vrij kunnen bewegen.
* in de vaste toestand , deze ionen worden in een vaste roosterstructuur gehouden, waardoor ze niet elektrische stroom kunnen dragen.
* Wanneer gesmolten of opgelost in een oplosmiddel , de ionen worden mobiel, waardoor ze elektrische stroom kunnen dragen.
Voorbeelden van elektrolyten:
* zouten: Natriumchloride (NaCl), kaliumchloride (KCL)
* zuren: Zoutzuur (HCL), zwavelzuur (H2SO4)
* Bases: Natriumhydroxide (NaOH), kaliumhydroxide (KOH)
Opmerking: Er zijn enkele uitzonderingen. Grafiet, een vaste vorm van koolstof, kan bijvoorbeeld elektriciteit leiden als gevolg van de gedelokaliseerde elektronen in zijn structuur.
 Hoe verschilt de formule voor waterstof van helium?
Hoe verschilt de formule voor waterstof van helium?  Wat zijn de gemeenschappelijke stoffen die worden gebruikt bij het lassen?
Wat zijn de gemeenschappelijke stoffen die worden gebruikt bij het lassen?  Onderzoekers ontwikkelen microscoop om lichtenergiestroom in fotosynthetische cellen te volgen
Onderzoekers ontwikkelen microscoop om lichtenergiestroom in fotosynthetische cellen te volgen Waarom kan natriumhydroxide -oplossing niet worden opgeslagen in aluminiumcontainers?
Waarom kan natriumhydroxide -oplossing niet worden opgeslagen in aluminiumcontainers?  Machine learning framework ID's doelen voor het verbeteren van katalysatoren
Machine learning framework ID's doelen voor het verbeteren van katalysatoren
 Hoe het milieu is veranderd sinds de eerste aardedag 51 jaar geleden
Hoe het milieu is veranderd sinds de eerste aardedag 51 jaar geleden  Wat is eigenlijk een 'veerkrachtig' bos?
Wat is eigenlijk een 'veerkrachtig' bos?  Finse batterijplannen wekken milieuvrees op
Finse batterijplannen wekken milieuvrees op Wetenschappers onthullen effecten van water op 660 km discontinuïteit in de diepe aarde
Wetenschappers onthullen effecten van water op 660 km discontinuïteit in de diepe aarde De aardbeving in Tehuantepec in Mexico in 2017 suggereert een nieuwe zorg
De aardbeving in Tehuantepec in Mexico in 2017 suggereert een nieuwe zorg
Hoofdlijnen
- Nieuwe RNA-gebaseerde tool kan hersencircuits verlichten, specifieke cellen bewerken
- Wat gebeurt er als een enzym wordt renatureerd?
- Wanneer de vulgreep wordt gebruikt om een cel aangrenzende cellen te kopiëren die wordt genoemd?
- Wat is chemosynthese en hoe verschilt dit van fotosynthese?
- Waarom is vrouwelijke seksualiteit flexibeler dan mannelijke seksualiteit?
- Volghalsbanden onthullen de geheimen van bavianen overvaltactieken
- Waarom is DNA de blauwdruk van het leven?
- Gouden nanodeeltje gebruikt om virus te vervangen in nieuwe CRISPR-aanpak
- Wat is een variabele van de disce?
- Superieure fotokatalysatoren - covalent, kristallijne triazine-frameworks
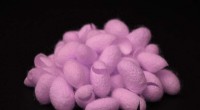
- Verrode fluorescerende zijde kan schadelijke bacteriën doden als biomedische en milieuremedie
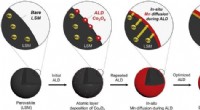
- Nieuwe katalysator geeft een boost aan de volgende generatie EV-batterijen
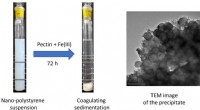
- Interactie tussen nanoplastics en pectine, een in water oplosbaar polysacharide
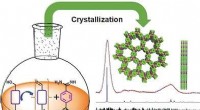
- Wetenschappers ontdekken bij toeval zeldzame clusterverbinding

 De nieuwe COP26 wereldwijde methaanbelofte
De nieuwe COP26 wereldwijde methaanbelofte Hoe cafeïne werkt
Hoe cafeïne werkt  Wanneer algen op een luiheid leeft, wordt dit als wederzijdse relatie beschouwd. Waarom dit een voorbeeld van mutualisme?
Wanneer algen op een luiheid leeft, wordt dit als wederzijdse relatie beschouwd. Waarom dit een voorbeeld van mutualisme?  Wat is er werkelijk aan de hand in de 'Tesla Tower'?
Wat is er werkelijk aan de hand in de 'Tesla Tower'?  Wat waakzame inktvissen ons kunnen leren over het doel van pijn
Wat waakzame inktvissen ons kunnen leren over het doel van pijn  Welke structuren wijzen de gasvormige reactanten en producten van fotosynthese toe om naar buiten te gaan?
Welke structuren wijzen de gasvormige reactanten en producten van fotosynthese toe om naar buiten te gaan?  NASA test atoomklok voor navigatie in de diepe ruimte
NASA test atoomklok voor navigatie in de diepe ruimte Designer-enzym overwint sulfietreductie, een knelpunt bij het opruimen van het milieu
Designer-enzym overwint sulfietreductie, een knelpunt bij het opruimen van het milieu
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

