
Wetenschap
Wat is de moleculaire formule van een stof met een empirische C2H5 en massa 58 gram per mol?
Hier leest u hoe u de moleculaire formule kunt bepalen:
1. Bereken de empirische formulemassa:
* Koolstof (c):2 atomen * 12.01 g/mol =24,02 g/mol
* Waterstof (h):5 atomen * 1,01 g/mol =5,05 g/mol
* Totale empirische formulemassa:24.02 + 5.05 =29.07 g/mol
2. Bepaal de verhouding tussen de moleculaire massa en empirische formulemassa:
* Moleculaire massa / empirische formulemassa =58 g / mol / 29.07 g / mol ≈ 2
3. Vermenigvuldig de subscripts in de empirische formule met de verhouding:
* C₂h₅ * 2 = c₄h₁₀
Daarom is de moleculaire formule van de stof C₄h₁₀.
 Kan baking soda het milieu redden?
Kan baking soda het milieu redden?  Veranderingen in de sneeuwbedekking bedreigen de biodiversiteit van de Arctische natuur
Veranderingen in de sneeuwbedekking bedreigen de biodiversiteit van de Arctische natuur Sentinels moderniseren Europa's landbouwbeleid
Sentinels moderniseren Europa's landbouwbeleid NASA ziet windschering van invloed zijn op tropische storm Yagi
NASA ziet windschering van invloed zijn op tropische storm Yagi Sprankelende bronnen helpen bij zoektocht naar ondergrondse warmte-energiebronnen
Sprankelende bronnen helpen bij zoektocht naar ondergrondse warmte-energiebronnen
Hoofdlijnen
- Noordelijke blootstelling:fossielen van een zuidelijke walvis voor het eerst gevonden in het noorden
- Hoe de Galapagos-eilanden werken
- Onderzoekers identificeren genen die mogelijk verantwoordelijk zijn voor de weerstand van suikerriet tegen plagen, kou en droogte
- De delen van een gistcel
- Hoe verlaat een groot deeltje de cel door actief transport?
- Bone apetit:hoe bacteriën bot eten om invasieve infecties in stand te houden
- Is DH5 Alpha Srain van E. coli is dam negatief?
- Invasieve habitat voor stinkwantsen kan enorm uitbreiden door klimaatverandering
- Wat veroorzaakt virussen bij mensen?
- Bananenschillen maken suikerkoekjes beter voor je

- Engineering enzymen om plantaardig afval om te zetten in duurzame producten

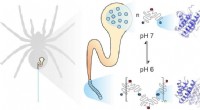
- Dynamiek van zijde-eiwitten is de sleutel tot uitstekende stabiliteit van spinzijde als biomateriaal
- Nieuwe verbindingen uit de zeester van het Kuril-bekken tonen werkzaamheid tegen kankercellen.

- Wetenschappers bepalen de bestemming voor eiwitten die zink leveren

 Eeuwenoude zeedieren brachten jaren door met het oversteken van de oceaan op vlotten – we hebben bedacht hoe het mogelijk was
Eeuwenoude zeedieren brachten jaren door met het oversteken van de oceaan op vlotten – we hebben bedacht hoe het mogelijk was Wat is Sir Isaac Newtons 1 wet?
Wat is Sir Isaac Newtons 1 wet?  Lost acid Oil?
Lost acid Oil?  Wetenschappers ontdekken dat Euraziatische Vlaamse gaaien net als mensen mentale tijdreizen kunnen gebruiken
Wetenschappers ontdekken dat Euraziatische Vlaamse gaaien net als mensen mentale tijdreizen kunnen gebruiken  Wetenschappers ontdekken meer dan 600 nieuwe periodieke banen van het beroemde drielichamenprobleem
Wetenschappers ontdekken meer dan 600 nieuwe periodieke banen van het beroemde drielichamenprobleem Goud schijnt door eigenschappen van nano-biosensoren
Goud schijnt door eigenschappen van nano-biosensoren Vegende lasers klikken geometrische rasters op nanoschaal in elkaar
Vegende lasers klikken geometrische rasters op nanoschaal in elkaar In welk phylum zit de vleermuis?
In welk phylum zit de vleermuis?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

