
Wetenschap
Dynamiek van zijde-eiwitten is de sleutel tot uitstekende stabiliteit van spinzijde als biomateriaal
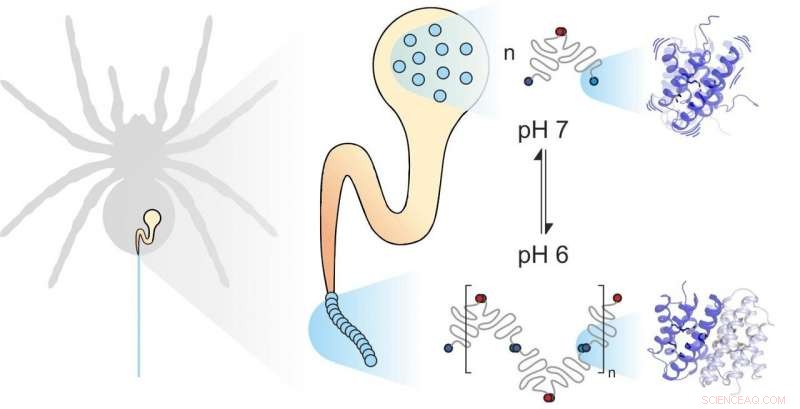
Spinzijde is samengesteld uit individuele eiwitten. Mechanische en chemische factoren beïnvloeden hoe ze assembleren. De dynamiek van de subunits speelt een belangrijke rol. Krediet:Benedikt Goretzki, Ute Hellmich
Spinzijde bestaat uit vezelvormende eiwitten, opgeslagen door de spin in een gespecialiseerde klier. Als de spin zijde nodig heeft, bijvoorbeeld om een web te bouwen, het extrudeert de zijde-eiwitten door een lang kanaal waarin ze worden blootgesteld aan specifieke mechanische en chemische invloeden en worden samengevoegd tot zijde. Spinzijde eiwitten, zoals alle eiwitten, bestaat uit 20 elementaire bouwstenen die bekend staan als aminozuren. Het aantal en de volgorde van deze aminozuren bepaalt de eigenschappen van individuele eiwitten. Bijvoorbeeld, als hydrofobe aminozuren zoals leucine zich in het centrum van een eiwit bevinden, het resultaat is een aanzienlijke structurele stabiliteit. Je zou dus verwachten dat de oersterke spinzijde veel leucine bevat. Tot hun grote verbazing echter, wetenschappers van de universiteiten van Mainz en Würzburg ontdekten dat een andere bouwsteen, methionine, is zeer overvloedig aanwezig in sommige spinnenzijde-eiwitten.
Van methioninezijketens is bekend dat ze zeer flexibel zijn. "Het was deze overvloed aan methionine in het spinzijde-eiwit dat ons de dynamiek ervan deed nader bekijken, " zei professor Ute Hellmich van de Johannes Gutenberg Universiteit Mainz (JGU). "Onze samenwerking met het team van Dr. Hannes Neuweiler aan de Julius-Maximilians-Universität Würzburg (JMU) gaf ons toegang tot ultramoderne biofysische onderzoekstools. "
De Würzburg-groep substitueerde systematisch het aminozuur methionine in spinzijde-eiwitten met leucine en vergeleek de vouwing, stabiliteit, en dynamiek van de resulterende eiwitvarianten met behulp van foto-geïnduceerde elektronenoverdracht fluorescentiecorrelatiespectroscopie (PET-FCS). Dr. Hannes Neuweiler speelde een belangrijke rol bij de ontwikkeling van deze techniek, en zijn laboratorium is een wereldleider in het gebruik ervan om biologische systemen te onderzoeken. Het team van professor Ute Hellmich onderzocht vervolgens de structuur en dynamiek van de twee eiwitvarianten met behulp van hoge resolutie nucleaire magnetische resonantie (NMR) spectroscopie. "We voeren onze NMR-metingen uit in het Center for Biomolecular Magnetic Resonance aan de Goethe University Frankfurt - nog een voorbeeld van het potentieel dat wordt gegenereerd door onze samenwerking in het Rijn-Main University-netwerk, ’ benadrukt Hellmich.
Methionine-bouwstenen in spinnenzijde-eiwitten zorgen voor flexibiliteit
Door PET-FCS- en NMR-spectroscopie te combineren, kwamen de twee onderzoeksgroepen tot de onverwachte conclusie dat methionine in spinzijde-eiwit de flexibiliteit van de eiwitstructuur verhoogt, en dat deze flexibiliteit precies is wat de individuele eiwitten in spinnenzijde in staat stelt om nauw samen te werken. "We ontdekten dat het vervangen van methionine door leucine geen effect heeft op de spinzijde-eiwitstructuur. beide eiwitten zien er precies hetzelfde uit. Tegelijkertijd, echter, het natuurlijke methionine-bevattende eiwit bindt veel sterker aan andere spinzijde-eiwitten. Het leucine-bevattende eiwit dat we in het laboratorium hebben gesynthetiseerd, verliest grotendeels dit vermogen om dergelijke stabiele verbindingen te vormen, " merkte Benedikt Goretzki op, een promovendus in het team van Hellmich en een van de twee hoofdauteurs van de studie gepubliceerd in Natuurcommunicatie . "We waren echt verbaasd, omdat dit aantoont dat niet alleen de vorm van een eiwit bepaalt hoe het functioneert, maar ook, in aanzienlijke mate, zijn flexibiliteit."
"Methionine maakt het eiwit niet alleen dynamischer, het verbetert ook de functionaliteit. In werkelijkheid, het stelt twee eiwitten in staat om specifiek met elkaar te linken, wat anders onmogelijk zou zijn, zelfs als ze dezelfde structuur hadden, " verduidelijkte Julia Heiby, promovendus in de groep van Neuweiler en de andere hoofdauteur van de studie.
"Vorm volgt functie" is een vuistregel in de structurele biologie. Met andere woorden, wat een eiwit meestal doet, kan uit zijn driedimensionale structuur worden afgeleid. "Het is indrukwekkend hoe de natuur ook de functie van eiwitten kan beïnvloeden door hun dynamiek precies aan te passen, ", voegde de in Mainz gevestigde biochemicus professor Ute Hellmich eraan toe.
Op basis van deze bevindingen, het kan nu mogelijk zijn om selectief de eigenschappen van spinzijde-eiwitten te wijzigen, bijvoorbeeld, om nieuwe zeer stabiele biomaterialen te synthetiseren. In aanvulling, de twee groepen hopen ook algemene inzichten te verschaffen in de relevantie van de dynamiek van eiwitten in relatie tot hun biologische functies. "Eiwitdynamiek is belangrijk in alle aspecten van het leven, " concludeerde Hellmich. "Dit geldt voor zowel spinnen als mensen."
 Nieuwe enzymontdekking kan geneesmiddelen tegen kanker helpen verbeteren, diabetes en obesitas
Nieuwe enzymontdekking kan geneesmiddelen tegen kanker helpen verbeteren, diabetes en obesitas Machine learning versnelt simulaties in materiaalkunde
Machine learning versnelt simulaties in materiaalkunde Een nieuw recept voor luchtstabiel en hoogkristallijn radicaal-gebaseerd coördinatiepolymeer
Een nieuw recept voor luchtstabiel en hoogkristallijn radicaal-gebaseerd coördinatiepolymeer Chemie maakt de weg vrij voor verbeterde elektronische materialen
Chemie maakt de weg vrij voor verbeterde elektronische materialen 3D-printen van het allereerste biomimetische tongoppervlak
3D-printen van het allereerste biomimetische tongoppervlak
Hoofdlijnen
- Rollen van celorganellen in mitose
- Zijn psychische aandoeningen genetisch bepaald?
- 6 veelvoorkomende hallucinaties en wat ze ons vertellen
- Lijst van de stappen van de celcyclus in volgorde
- Hoe soorten versteend hout te identificeren
- Onderzoekers observeren enzymen die cellulose afbreken om de productie van biobrandstoffen te ondersteunen
- Slangenmans gifgewoonte houdt hoop op nieuw tegengif
- Hoe de bacteriegroei in petrischalen te meten
- Wat gebeurt er in de interfase van de celcyclus?
- Supramoleculaire complexvorming - antraceen macrocyclus en C60 fullereen

- Theorie zou de push voor spintronische apparaten kunnen versnellen
- Water splitsen voor de prijs van een nikkel
- Hoe te testen of alcohol Methanol

- Nieuw apparaat detecteert snel lithiumionen in bloed van patiënten met bipolaire stoornis
 Hubble is de ultieme multitasker:asteroïden ontdekken terwijl hij andere waarnemingen doet
Hubble is de ultieme multitasker:asteroïden ontdekken terwijl hij andere waarnemingen doet Experts bekritiseren Amerikaanse luchtvaartautoriteit over 737 MAX:bron
Experts bekritiseren Amerikaanse luchtvaartautoriteit over 737 MAX:bron De elektriciteitssector in Australië moet de CO2-uitstoot tegen 2030 met 45% verminderen
De elektriciteitssector in Australië moet de CO2-uitstoot tegen 2030 met 45% verminderen Een vakantiewonder? Winkels proberen lange rijen te verminderen
Een vakantiewonder? Winkels proberen lange rijen te verminderen Hotspot op Hawaï? Niet zo snel
Hotspot op Hawaï? Niet zo snel Handen schudden of niet? Een eeuwenoud menselijk gebaar nu in het ongewisse
Handen schudden of niet? Een eeuwenoud menselijk gebaar nu in het ongewisse Ringresonatoren hoeklicht
Ringresonatoren hoeklicht Tweetalige mash-ups:contra-intuïtieve bevindingen uit sociolinguïstiek
Tweetalige mash-ups:contra-intuïtieve bevindingen uit sociolinguïstiek
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

