
Wetenschap
Hoe ziet Bohrs -model van het atoom eruit?
* kern in het midden: Net als de zon bevat de kern de protonen en neutronen, waardoor het atoom zijn positieve lading en het grootste deel van zijn massa krijgt.
* elektronen in banen: Elektronen draaien de kern in specifieke, cirkelvormige paden die "energieniveaus" of "schelpen" worden genoemd. Deze banen worden gekwantiseerd, wat betekent dat elektronen alleen op bepaalde afzonderlijke afstanden van de kern kunnen bestaan.
* energieniveaus: Elk energieniveau heeft een specifieke energie die eraan is gekoppeld. Elektronen in hogere energieniveaus zijn verder van de kern en hebben meer energie.
* Elektronen springt: Elektronen kunnen tussen energieniveaus springen door energie te absorberen of uit te stoten. Wanneer een elektron energie absorbeert (bijvoorbeeld van licht), beweegt het naar een hoger energieniveau. Wanneer het energie verliest (bijvoorbeeld door licht uit te zenden), beweegt het naar een lager energieniveau.
Hier is een eenvoudige manier om het te visualiseren:
Stel je een kleine zon voor in het midden, die de kern vertegenwoordigt. Stel je dan voor dat planeten rond deze zon draaien op specifieke, vaste afstanden. Deze planeten vertegenwoordigen de elektronen die rond de kern draaien in hun respectieve energieniveaus.
Beperkingen van het model van Bohr:
Hoewel het model van Bohr een belangrijke stap voorwaarts was in het begrijpen van de atoomstructuur, heeft het enkele beperkingen:
* Onjuiste elektronenpaden: Elektronen draaien eigenlijk niet om de kern in perfect cirkelvormige paden. Hun beweging is complexer en beschreven door waarschijnlijkheidswolken.
* faalt voor grotere atomen: Het model van Bohr werkt goed voor waterstof, maar het voorspelt niet nauwkeurig het gedrag van elektronen in atomen met meerdere elektronen.
Modern begrip van het atoom:
Het huidige begrip van het atoom is gebaseerd op het kwantummechanische model, dat een meer accurate en complexe beschrijving van elektronengedrag biedt. Het model van Bohr is echter nog steeds een waardevol hulpmiddel voor het visualiseren van de basisstructuur van het atoom.
 Waarom vindt er een kleurverandering plaats tijdens het titreren van zout tegen kaliumdichromaat?
Waarom vindt er een kleurverandering plaats tijdens het titreren van zout tegen kaliumdichromaat?  Vegan spinzijde biedt duurzaam alternatief voor plastic voor eenmalig gebruik
Vegan spinzijde biedt duurzaam alternatief voor plastic voor eenmalig gebruik Wat wordt er tijdens één enkele draai van de citroenzuurcyclus gegenereerd?
Wat wordt er tijdens één enkele draai van de citroenzuurcyclus gegenereerd?  Zeewaterbacteriën bieden aanknopingspunten om melanoom te bestrijden
Zeewaterbacteriën bieden aanknopingspunten om melanoom te bestrijden Science Project Egg Experiments
Science Project Egg Experiments
 Duitsland registreert heetste jaar in een eeuw
Duitsland registreert heetste jaar in een eeuw Brand op de Canarische Eilanden die beschermde gebieden bedreigde, neemt af
Brand op de Canarische Eilanden die beschermde gebieden bedreigde, neemt af Bosbranden in Californië:oplossingen zoeken voor een wicked problem
Bosbranden in Californië:oplossingen zoeken voor een wicked problem Onthulling van de nauwkeurigheid van tsunami-voorspellingen
Onthulling van de nauwkeurigheid van tsunami-voorspellingen Grote Antarctische ijsplaat, thuisbasis van een Brits onderzoeksstation, staat op het punt uit elkaar te vallen
Grote Antarctische ijsplaat, thuisbasis van een Brits onderzoeksstation, staat op het punt uit elkaar te vallen
Hoofdlijnen
- Net als doorgewinterde vakantieliefhebbers, majoid krabben versieren hun schelpen
- Nieuwe vliegsoort in Central Park krijgt bijnaam CCNY-professoren
- Bij-nabootsende kaalvleugelmot zoemt na 130 jaar weer tot leven
- Wat zijn chromosomen die dezelfde lengte hebben en genen voor eigenschappen dragen?
- DNA uit fossiele eierschalen onthult hoe uitgestorven olifantsvogels leefden
- Fibroblasten zijn de typische cellen van?
- Bevat een voedselweb slechts één roofdier en ketting?
- Wat is het belangrijkste verschil tussen een plant en een dierencel?
- Het ontsluiten van de geheimen van hoe cellen communiceren biedt inzichten in de behandeling van ziekten
- Annotatietool biedt een stap in de richting van het begrijpen van verbanden tussen ziekte, gemuteerd RNA
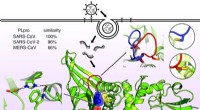
- Informatie over de moleculaire vorm van virussen die COVID-19 veroorzaken, SARS, en MERS onthult structurele overeenkomsten
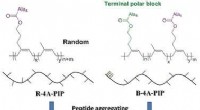
- Biomimetische strategie leidt tot sterke, recyclebaar rubber
- Cellulose nanovezels kunnen helpen om deeltjes in inkt en gedrukte elektronica gelijkmatig te verspreiden
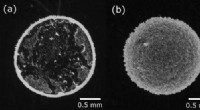
- Snelle vloeistofverpakking:watersilhouetten insluiten in 3D-polymeermembranen voor lab-in-a-drop-experimenten

 Wat zijn vier uitscheidingsproducten en vermelden de organen die ze produceren?
Wat zijn vier uitscheidingsproducten en vermelden de organen die ze produceren?  Hoe de natuurlijke ‘glazuren’ op de muren van Kimberley-schuilplaatsen helpen onthullen waar kunstenaars in de wereld woonden
Hoe de natuurlijke ‘glazuren’ op de muren van Kimberley-schuilplaatsen helpen onthullen waar kunstenaars in de wereld woonden  Waarom doet zuivere salpeterzuur met vochtige lucht?
Waarom doet zuivere salpeterzuur met vochtige lucht?  Megacruises worden kopieën van de grote resorts in Las Vegas
Megacruises worden kopieën van de grote resorts in Las Vegas Santos-aandelen stijgen na overnamebod Harbor Energy
Santos-aandelen stijgen na overnamebod Harbor Energy Bacteriën misleiden om benzeen te hydroxyleren
Bacteriën misleiden om benzeen te hydroxyleren Kan deze invasieve exotische plaag betere materialen opleveren voor de industrie en de geneeskunde?
Kan deze invasieve exotische plaag betere materialen opleveren voor de industrie en de geneeskunde?  Fysieke training is de volgende hindernis voor kunstmatige intelligentie, zegt onderzoeker
Fysieke training is de volgende hindernis voor kunstmatige intelligentie, zegt onderzoeker
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

