Wetenschap
Informatie over de moleculaire vorm van virussen die COVID-19 veroorzaken, SARS, en MERS onthult structurele overeenkomsten
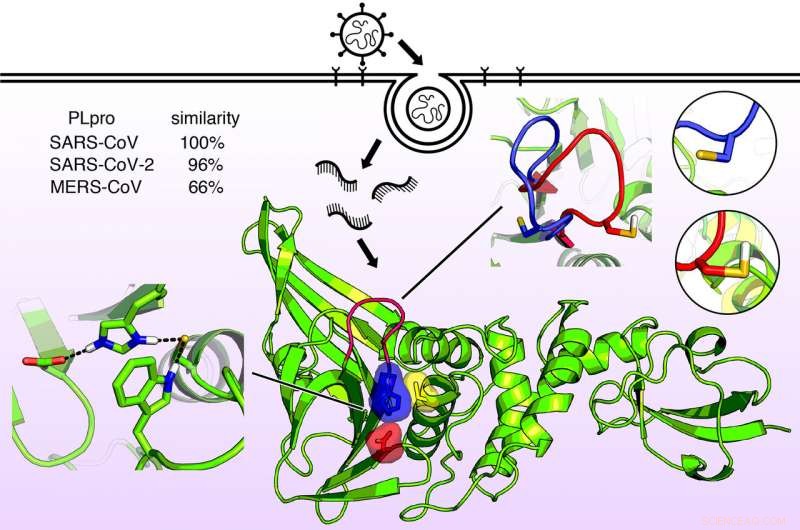
Moleculaire structuur van het papaïneachtige enzym dat bekend staat als PLPro. Dit enzym zorgt ervoor dat de virussen die SARS veroorzaken, MERS, en COVID-19 om cellen te infecteren en de immuunfunctie van de gastheer te repliceren en te onderdrukken. Nu de enzymstructuur in detail bekend is, nieuwe antivirale middelen kunnen worden ontworpen. Krediet:Jack Henderson, University of Maryland School of Pharmacy
COVID-19 wordt veroorzaakt door een virus dat bekend staat als SARS-CoV-2, die qua structuur vergelijkbaar is met twee andere virussen die recente uitbraken hebben veroorzaakt:SARS-CoV, die in 2003 een uitbraak van SARS veroorzaakte, en MERS-CoV, de oorzaak van een uitbraak van het ademhalingssyndroom in het Midden-Oosten in 2012.
In de Tijdschrift voor Chemische Fysica , wetenschappers van de University of Maryland School of Pharmacy rapporteren onderzoek op moleculair niveau van deze drie virussen, het bieden van een mogelijke weg naar nieuwe antivirale geneesmiddelen om alle drie de ziekten te bestrijden. Op dit moment, er bestaat geen effectieve behandeling of medicijnen voor een van deze coronavirusziekten.
De onderzoekers keken naar een viraal eiwit dat een sleutelrol speelt in het vermogen van het virus om zichzelf eenmaal in het lichaam te repliceren. Dit eiwit speelt ook een rol bij het verslaan van het immuunsysteem van de gastheer, dus het biedt een bijzonder aantrekkelijk doelwit voor mogelijke medicamenteuze behandelingen.
het eiwit, een enzym dat bekend staat als het papaïneachtige protease, PLPro, is bijna identiek in SARS-CoV-2 en SARS-CoV, maar is iets anders in MERS-CoV. Zeer onlangs, de eerste structurele röntgenfoto van dit enzym onthulde een vorm in het katalytische domein die enigszins leek op een hand met een "duim, " "palm, ' en 'vingers'.
De duim en handpalm komen samen om een bindingsplaats te vormen, waar een medicijnmolecuul mogelijk kan worden gevangen. De vingers vouwen over dit gebied naar beneden en zorgen voor structurele integriteit die essentieel is voor PLPro-activiteit.
De onderzoekers ontdekten dat kleine pH-verschuivingen de vorm van dit enzym kunnen veranderen door een proces dat bekend staat als protonering. waar waterstofionen binden aan bepaalde aminozuureenheden in het eiwit.
"Protonatiestatusschakelaar is een belangrijk energietransductiemechanisme, ", zei auteur Jana Shen.
Co-auteur Jack Henderson zei:"Het coronavirus spike-eiwit, bijvoorbeeld, maakt gebruik van protonatietoestandsschakelaars om grote conformationele veranderingen te induceren die nodig zijn voor membraanfusie."
Membraanfusie is de eerste stap in infectie. Een virus hecht zich aan het buitenmembraan van een cel, zijn weg naar binnen vindend waar het kopieën van zichzelf kan beginnen te vormen die zich door het lichaam verspreiden.
Een ander belangrijk kenmerk van de PLpro-bindingsplaats is een reeks aminozuureenheden die de BL2-lus wordt genoemd. De onderzoekers ontdekten dat deze lus kan openen of sluiten in SARS-virussen wanneer een bepaald aminozuur op de lus geprotoneerd of gedeprotoneerd is. Bij het MERS-virus, echter, de lus is zelfs zonder zo'n aminozuur flexibel.
Deze functie suggereert dat een potentieel medicijn zich zou kunnen richten op de BL2-lus, waardoor het zich sluit en stevig bindt aan een virale remmer.
"Ons werk biedt een startpunt voor verder mechanisch onderzoek met behulp van benaderingen op een hoger niveau, " zei Sheen.
 Een lijst van natuurlijke bronnen van Noord-Carolina
Een lijst van natuurlijke bronnen van Noord-Carolina  Onderzoekers combineren Zillow- en volkstellingsgegevens om de waterbehoefte van woningen te bepalen
Onderzoekers combineren Zillow- en volkstellingsgegevens om de waterbehoefte van woningen te bepalen Klimaatverandering moet onderdeel zijn van reguliere spaar- en investeringsbeslissingen
Klimaatverandering moet onderdeel zijn van reguliere spaar- en investeringsbeslissingen De samenstelling van de maricultuur:onderzoekers onderzoeken wereldwijde trends in de visteelt
De samenstelling van de maricultuur:onderzoekers onderzoeken wereldwijde trends in de visteelt Lidar-onderzoek suggereert dat de verliezen aan koolstofopslag groter zijn dan gedacht in Amazone als gevolg van verliezen aan de rand van bossen
Lidar-onderzoek suggereert dat de verliezen aan koolstofopslag groter zijn dan gedacht in Amazone als gevolg van verliezen aan de rand van bossen
Hoofdlijnen
- Het leefgebied van de panda krimpt, steeds meer gefragmenteerd worden
- Zoogdieren schakelden over op dagactiviteit na uitsterven van dinosauriërs
- Onderzoek toont aan dat plantengroeiregulatoren gunstig kunnen zijn voor de vestiging van uien, productie
- Chinese wetenschappers onthullen een nieuwe signaalroute voor koude tolerantie in rijst
- Bacteriën als pacemaker voor de darm
- Twee eiwitten behouden de pluripotentie van embryonale stamcellen op verschillende manieren
- Eetbaar diercelproject met Candy
- Bioom: definitie, types, kenmerken en voorbeelden
- Het verkennen van een oude gebeurtenis in pompoen, evolutie van kalebas en meloen
 De eerste waarneming van het superverstrooiingseffect van metamaterialen
De eerste waarneming van het superverstrooiingseffect van metamaterialen Een opschaalbare nanoporeuze membraancentrifuge voor ontzilting door omgekeerde osmose zonder vervuiling
Een opschaalbare nanoporeuze membraancentrifuge voor ontzilting door omgekeerde osmose zonder vervuiling Het ontwerpen van diepzee-olieplatforms kan worden verbeterd door vereenvoudigde golfsimulaties
Het ontwerpen van diepzee-olieplatforms kan worden verbeterd door vereenvoudigde golfsimulaties Hackers richten zich op Airbus-leveranciers op zoek naar commerciële geheimen
Hackers richten zich op Airbus-leveranciers op zoek naar commerciële geheimen De Krebs-cyclus gemakkelijk gemaakt
De Krebs-cyclus gemakkelijk gemaakt  Heeft het universum een rustframe?
Heeft het universum een rustframe? Goud voor ijzeren nanokubussen
Goud voor ijzeren nanokubussen De nieuwe raciale ongelijkheid in het speciaal onderwijs
De nieuwe raciale ongelijkheid in het speciaal onderwijs
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com