
Wetenschap
Hoe reageren de alkalimetaalverbindingen op ammoniumverbindingen?
reactie:
De reactie tussen alkalimetaalverbindingen en ammoniumverbindingen resulteert in de vorming van ammoniakgas (NH3) , water (H2O) , en het overeenkomstige alkali metaalzout .
Algemene vergelijking:
`` `
M (OH) + NH4X → NH3 + H2O + MX
`` `
Waar:
* m: Alkali metaal (bijv. NA, K, Li)
* oh: Hydroxide -ion
* NH4X: Ammoniumzout (bijv. NH4CL, NH4NO3)
* NH3: Ammoniakgas
* h2o: Water
* mx: Alkali metaalzout (bijv. NaCl, KCL, LiCl)
Voorbeeld:
De reactie tussen natriumhydroxide (NaOH) en ammoniumchloride (NH4CL) produceert ammoniakas, water en natriumchloride (NaCl):
`` `
NaOH + NH4CL → NH3 + H2O + NaCl
`` `
mechanisme:
De reactie vindt plaats in twee stappen:
1. Protonoverdracht: Het hydroxide -ion van de alkali metaalverbinding valt het ammoniumion aan uit de ammoniumverbinding, waarbij een proton (H+) wordt verwijderd en water vormt.
2. Ammoniakvorming: Het resterende ammoniumion (NH3+) verliest een ander proton om ammoniakgas te vormen.
Observaties:
* De reactie gaat vaak gepaard met de afgifte van een scherpe geur, kenmerkend voor ammoniakgas.
* Als de reactie in een gesloten systeem wordt uitgevoerd, zal de druk binnen het systeem toenemen als gevolg van de vorming van ammoniakgas.
Toepassingen:
Deze reactie wordt in verschillende toepassingen gebruikt, waaronder:
* Productie van ammoniak: Deze reactie kan worden gebruikt om ammoniakas in het laboratorium te produceren.
* Analyse van ammoniumverbindingen: De reactie kan worden gebruikt om ammoniumverbindingen in monsters te detecteren en te kwantificeren.
* Verwijdering van ammoniak uit afvalwater: Deze reactie kan worden gebruikt om ammoniak uit afvalwater te verwijderen door het te reageren met een alkalimetaalhydroxide.
Veiligheidsmaatregelen:
* Ammoniakgas is giftig en kan schadelijk zijn als het wordt ingeademd.
* De reactie kan exotherme zijn en kan warmte produceren.
* Behandel altijd alkalimetaalverbindingen en ammoniumverbindingen met zorg en draag passende veiligheidsuitrusting.
 Microbiële brandstofcel zet methaan om in elektriciteit
Microbiële brandstofcel zet methaan om in elektriciteit Cementfabrieken kunnen de wereldwijde plasticvervuiling afremmen
Cementfabrieken kunnen de wereldwijde plasticvervuiling afremmen Wat is er zo speciaal aan koolstofverbindingen dat ze er een hele tak van chemie aan hebben gewijd?
Wat is er zo speciaal aan koolstofverbindingen dat ze er een hele tak van chemie aan hebben gewijd?  Wat zijn de verschillen tussen oplosbaarheid en mengbaarheid?
Wat zijn de verschillen tussen oplosbaarheid en mengbaarheid?  Welke twee elementen konden worden gevormd uit de ontleding van bariumfosfide BA3P2?
Welke twee elementen konden worden gevormd uit de ontleding van bariumfosfide BA3P2?
Hoofdlijnen
- Wat zijn de vier theorieën over ziekteveroorzaak?
- Waar komt water uit het metabolisme vandaan?
- Wat is een reproductie?
- Rol van sucrose in DNA -isolatie uit menselijk bloed?
- Wat zijn de twee functies van eiwitten?
- Wat is inverto-bevruchting?
- Leef snel, sterf jong:signaaldetectietheorie bijwerken
- Welk gevoel kan gemakkelijk worden gebruikt om de aanwezigheid van gist op kweekplaat te bepalen?
- Wat zijn de wetenschappelijke classificaties van zeewier?
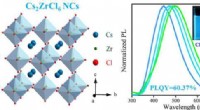
- Wetenschappers synthetiseren loodvrije op zirkonium gebaseerde vacature-geordende dubbele perovskiet nanokristallen
- Nieuwe isomere vinyleen-gekoppelde covalente organische raamwerken ontwikkeld met duidelijke fotokatalytische eigenschappen
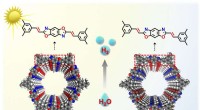
- Wetenschappers melden voor het eerst zware ionenoverdracht in geladen vdW-cluster

- Ons DNA wordt 's werelds kleinste harde schijf
- Een nucleair ongeval met vermalen mineralen bevatten

 Bodembedekkers kunnen profiteren van warme, droge gronden
Bodembedekkers kunnen profiteren van warme, droge gronden Een eindtemperatuur berekenen
Een eindtemperatuur berekenen Luchtvervuiling sluit scholen in Iraanse hoofdstad
Luchtvervuiling sluit scholen in Iraanse hoofdstad Gegevens die door overheden worden verzameld, kunnen nuttig zijn voor onderzoekers, maar alleen bij zorgvuldige toegang
Gegevens die door overheden worden verzameld, kunnen nuttig zijn voor onderzoekers, maar alleen bij zorgvuldige toegang Wat is in Nephron de vloeistof die voorafgaat aan urine?
Wat is in Nephron de vloeistof die voorafgaat aan urine?  Nieuwe theorie van klimaatdynamiek:ontleding in drie patronen van de mondiale atmosferische circulatie
Nieuwe theorie van klimaatdynamiek:ontleding in drie patronen van de mondiale atmosferische circulatie Onderzoekers onthullen de evolutionaire oorsprong van eetlust door het eenvoudige zenuwstelsel van Hydra te bestuderen
Onderzoekers onthullen de evolutionaire oorsprong van eetlust door het eenvoudige zenuwstelsel van Hydra te bestuderen  Is SO2 een metaal of niet -metaal?
Is SO2 een metaal of niet -metaal?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

