
Wetenschap
Als een atoom zoals waterstof in staat is om een covalente binding te vormen, beschrijf dan wat er gebeurt wanneer de elektronenschalen van twee atomen overlappen?
1. De basis
* de structuur van de waterstof: Waterstof heeft één proton en één elektron. De elektronenconfiguratie is 1S¹, wat betekent dat het één elektron heeft in zijn eerste elektronenschil.
* Covalente binding: Covalente bindingen vormen zich wanneer twee atomen elektronen delen om een stabielere elektronenconfiguratie te bereiken. Met dit delen kan elk atoom zijn buitenste elektronenschaal effectief vullen.
2. Overlappende elektronenschalen
* Attractie: Wanneer twee waterstofatomen elkaar naderen, trekken hun positief geladen kernen de negatief geladen elektronen van het andere atoom aan.
* shell overlapping: Naarmate de atomen dichterbij komen, beginnen hun 1S -elektronenschalen elkaar te overlappen. Dit betekent dat de elektronen van elk atoom zich nu binnen de invloedssfeer van beide kernen bevinden.
* Elektronen delen: Door de overlapping van de elektronenschillen kunnen de twee elektronen (één van elk waterstofatoom) gelokaliseerd worden in het gebied tussen de twee kernen. Dit gedeeld paar elektronen wordt nu aangetrokken tot beide kernen en houdt de atomen bij elkaar.
3. Het resultaat:een covalente binding
* stabiliteit: De gedeelde elektronen vullen effectief de buitenste elektronenschalen van beide waterstofatomen en bereiken een stabiele, edelgasachtige configuratie.
* Lagere energie: Het delen van elektronen vermindert de totale energie van het systeem, waardoor de binding stabiel is.
* Het H2 -molecuul: De twee waterstofatomen bestaan nu als een enkel molecuul, H2.
Visualiseren het:
Stel je twee ballonnen voor, die elk een waterstofatoom vertegenwoordigen. De ballonnen hebben een enkele string aan elk bevestigd, die het elektron vertegenwoordigen. Wanneer de ballonnen in de buurt worden gebracht, overlappen de snaren (elektronen) en raken verstrikt. De verwarde snaren vertegenwoordigen de gedeelde elektronen en houden de twee ballonnen (waterstofatomen) bij elkaar.
Belangrijke opmerking: Deze beschrijving vereenvoudigt het concept. Het werkelijke elektronengedrag wordt bepaald door de kwantummechanica, die de elektronen beschrijft als waarschijnlijkheidsolken in plaats van verschillende punten. Het basisidee van gedeelde elektronen en een stabiele configuratie blijft echter hetzelfde.
 Van welk materiaal is chintz gemaakt?
Van welk materiaal is chintz gemaakt?  Door pneumatiek te combineren met een hydrogel om een baromorf te creëren - voor zachte robotica
Door pneumatiek te combineren met een hydrogel om een baromorf te creëren - voor zachte robotica Waarom neemt het percentage ionisatie van azijnzuur toe naarmate de concentratie oplossing afneemt?
Waarom neemt het percentage ionisatie van azijnzuur toe naarmate de concentratie oplossing afneemt?  Nieuwe techniek lokaliseert locaties van individuele moleculen in hun cellulaire buurten
Nieuwe techniek lokaliseert locaties van individuele moleculen in hun cellulaire buurten Hoeveel waterstofatomen zitten er in 7,00 mol ammoniumsulfide?
Hoeveel waterstofatomen zitten er in 7,00 mol ammoniumsulfide?
 Een vogelperspectief krijgen van de vergroening van het noordpoolgebied
Een vogelperspectief krijgen van de vergroening van het noordpoolgebied Satelliet toont post-tropische cycloon Selma verdwijnen
Satelliet toont post-tropische cycloon Selma verdwijnen Aswolken van Antarctische vulkanen kunnen het luchtverkeer op het zuidelijk halfrond verstoren
Aswolken van Antarctische vulkanen kunnen het luchtverkeer op het zuidelijk halfrond verstoren Enorme toename van bliksem boven het noordpoolgebied in het afgelopen decennium, uit onderzoek blijkt
Enorme toename van bliksem boven het noordpoolgebied in het afgelopen decennium, uit onderzoek blijkt Beslissing om de Waters of the United States rule (WOTUS) in te trekken op basis van gebrekkige analyse:studie
Beslissing om de Waters of the United States rule (WOTUS) in te trekken op basis van gebrekkige analyse:studie
Hoofdlijnen
- Op diamanten gebaseerde kwantumdetectiemicroscoop biedt een effectieve aanpak voor het kwantificeren van cellulaire krachten
- Voedingsgedrag kan een indicator zijn van voerefficiëntie bij Holstein-koeien
- Wat is de ademhaling van Paramecium?
- Afkoelend klimaat dreef de evolutie van de Tasmaanse duivel en zijn verwanten
- Hoe werkt het C4 -pad?
- Hoe beïnvloeden je hersenen je overlevingskansen in de wildernis?
- Chimpansees in gevangenschap vertonen tekenen van een aangetaste geestelijke gezondheid
- Nieuwe vooruitgang in de biologische fixatie van stikstof in rijst
- Een biohybride robot gemaakt van meel en haver zou kunnen fungeren als een biologisch afbreekbare vector voor herbebossing
- Video:Wat is er precies gebeurd in Tsjernobyl?

- Het moleculaire canvas schilderen in superresolutie

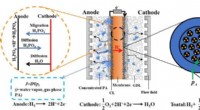
- Het voorspellen van de distributie van fosforzuur en water in een hoge-temperatuur polymeer elektrolytmembraan brandstofcel
- Nieuw apparaat identificeert bloeddonoren van hoge kwaliteit
- Op groene fluorescerende eiwitten gebaseerde glucose-indicatoren voor realtime monitoring van het glucosemetabolisme
 Google beweert dat zijn nowcast-weersvoorspellingen voor de korte termijn nauwkeuriger zijn dan geavanceerde modellen
Google beweert dat zijn nowcast-weersvoorspellingen voor de korte termijn nauwkeuriger zijn dan geavanceerde modellen Wat zijn 2 redenen waarom levende dingen planten nodig hebben?
Wat zijn 2 redenen waarom levende dingen planten nodig hebben?  Super Typhoon Noru-vaten richting Filipijnen
Super Typhoon Noru-vaten richting Filipijnen Wat is de naam voor samengestelde H2CO3?
Wat is de naam voor samengestelde H2CO3?  Waarom zien sterren er zo klein uit in vergelijking met de zon?
Waarom zien sterren er zo klein uit in vergelijking met de zon?  Vrouwen keren wereldwijd het tij in het klimaatbeleid en kunnen een nieuw tijdperk inluiden voor Australië
Vrouwen keren wereldwijd het tij in het klimaatbeleid en kunnen een nieuw tijdperk inluiden voor Australië Waar is de kern gevonden in de cel en waarom?
Waar is de kern gevonden in de cel en waarom?  Wat biedt het licht dat op de maan wordt gezien?
Wat biedt het licht dat op de maan wordt gezien?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

