
Wetenschap
Waarom neemt het percentage ionisatie van azijnzuur toe naarmate de concentratie oplossing afneemt?
Denk bijvoorbeeld aan de ionisatie van azijnzuur in water:
$$CH_3COOH + H_2O ⇌ CH_3COO^- + H_3O^+$$
Aanvankelijk is de concentratie van niet-geïoniseerd azijnzuur relatief hoog, dus gebaseerd op het principe van Le Châtelier en de evenwichtsconstante hieronder, ligt de evenwichtspositie aan de linkerkant, in het voordeel van de reactanten; er zijn relatief lage concentraties H+ en A-ionen:
$$K_a =\frac{[CH_3COO^-][H_3O^+]}{[CH_3COOH]}$$
Naarmate de concentratie azijnzuur afneemt (door verdunning), verschuift het evenwicht naar rechts. Deze verschuiving vindt plaats omdat er niet genoeg azijnzuurmoleculen in de oplossing zijn om te reageren met de meeste H+- en A-ionen. Daarom neemt de concentratie van zowel H+ als A-ionen toe, wat leidt tot een hogere dissociatie of ionisatie van azijnzuren in een verdunde oplossing.
 Vergrendelde MOF's zijn de sleutel tot hoge porositeit
Vergrendelde MOF's zijn de sleutel tot hoge porositeit Chemici gebruiken lichtenergie om kleine moleculaire ringen te produceren
Chemici gebruiken lichtenergie om kleine moleculaire ringen te produceren Hoe is het periodiek systeem georganiseerd?
Hoe is het periodiek systeem georganiseerd?  Astronauten voeren metallurgische experimenten uit aan boord van ISS
Astronauten voeren metallurgische experimenten uit aan boord van ISS Wat ontstaat er als een mengsel van citroenzuur en natriumwaterstofcarbonaat aan water wordt toegevoegd?
Wat ontstaat er als een mengsel van citroenzuur en natriumwaterstofcarbonaat aan water wordt toegevoegd?
 Plantaanpassingen in de toendra
Plantaanpassingen in de toendra  Bloedzuigende insecten en insecten
Bloedzuigende insecten en insecten Onderzoekers proberen te identificeren hoe gewassen kwetsbaar kunnen zijn voor aanvallen
Onderzoekers proberen te identificeren hoe gewassen kwetsbaar kunnen zijn voor aanvallen  Wetenschappers presenteren nieuwe methode voor teledetectie van atmosferische dynamiek
Wetenschappers presenteren nieuwe methode voor teledetectie van atmosferische dynamiek Is mijn merkimago groen of gezond? Geen dure enquêtes nodig, vraag het maar aan Twitter
Is mijn merkimago groen of gezond? Geen dure enquêtes nodig, vraag het maar aan Twitter
Hoofdlijnen
- Onderzoekers identificeren hoe bacteriën overleven in zuurstofarme omgevingen
- Wie zal roofzuchtige wetenschappelijke tijdschriften op afstand houden nu de blog van Jeffrey Beall verdwenen is?
- Hoe je gistademhaling meet
- De celstructuur van een ui
- Genetische mutatie verklaart de oorsprong van sommige menselijke organen
- Het team leert hoe cellulair eiwit virussen detecteert en een immuunrespons opwekt
- Lariats:Hoe beslissingen over RNA-splitsing worden genomen
- Hoe hoge bomen suikers verplaatsen
- Onderzoekers gezocht:mensen hoeven niet te solliciteren?
- Op schelpen geïnspireerde suikerschild beschermt materialen in vijandige omgevingen

- Ontwerpstrategie op moleculair niveau kan de sleutel zijn tot het stimuleren van commerciële waterstofproductie
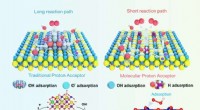
- Melkzuurbacteriën kunnen de houdbaarheid van voedingsmiddelen verlengen

- Cysteïnesynthese was een belangrijke stap in het ontstaan van leven:studie

- Nieuwe combinatie van materialen zorgt voor recordbrekende lithium-metaalcel
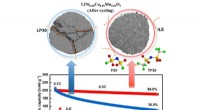
 De koning van de gewassen kronen:het genoom van de witte Guinea-yam bepalen
De koning van de gewassen kronen:het genoom van de witte Guinea-yam bepalen Boomringen kunnen de uitbarstingsdatum van de Thera-vulkaan bepalen
Boomringen kunnen de uitbarstingsdatum van de Thera-vulkaan bepalen Onderzoekers ontdekken hoe het westnijlvirus overleeft in muggen
Onderzoekers ontdekken hoe het westnijlvirus overleeft in muggen  Human Heart Science Projects
Human Heart Science Projects Dallas is slechts de nieuwste overstromingsramp:hoe steden kunnen leren van de huidige klimaatcrises om zich voor te bereiden op morgen
Dallas is slechts de nieuwste overstromingsramp:hoe steden kunnen leren van de huidige klimaatcrises om zich voor te bereiden op morgen Wetenschappers bestuderen veranderingen in de biodiversiteit van de zandstranden van Californië
Wetenschappers bestuderen veranderingen in de biodiversiteit van de zandstranden van Californië James Webb Observatory bereidt zich voor op aanvullende tests
James Webb Observatory bereidt zich voor op aanvullende tests Schapenboeren kunnen profiteren door over te schakelen naar bos, uit onderzoek blijkt
Schapenboeren kunnen profiteren door over te schakelen naar bos, uit onderzoek blijkt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

