
Wetenschap
Wat is de relatie tussen het aantal ongepaarde elektronen en overgangsmetaal van de hardheid?
Algemene trend:
* meer ongepaarde elektronen leiden over het algemeen tot hardere metalen. Dit komt omdat ongepaarde elektronen bijdragen aan een sterkere metalen binding.
* Niet -gepaarde elektronen creëren sterkere magnetische interacties, wat leidt tot hogere smeltpunten en grotere weerstand tegen vervorming.
* Deze interacties dragen ook bij aan sterkere interatomische krachten, waardoor het metaal harder wordt.
factoren die de hardheid beïnvloeden:
* Atomaire maat: Kleinere atoomgrootte leidt in het algemeen tot hardere metalen. Dit komt omdat kleinere atomen een grotere elektronendichtheid en sterkere interatomische krachten hebben.
* Elektronische configuratie: De specifieke opstelling van elektronen in de D -orbitalen kan de hardheid beïnvloeden.
* kristalstructuur: De opstelling van atomen in het kristalrooster van een metaal kan de hardheid aanzienlijk beïnvloeden.
* legeringen: De aanwezigheid van andere elementen kan de hardheid van een overgangsmetaal veranderen.
Uitzonderingen en complicaties:
* Niet alle overgangsmetalen met een hoge aantallen ongepaarde elektronen zijn moeilijk. Mangaan (MN) heeft bijvoorbeeld vijf ongepaarde elektronen maar is relatief zacht.
* andere factoren naast niet -gepaarde elektronen kunnen een belangrijke rol spelen bij het bepalen van de hardheid. De sterkte van de metalen binding wordt bijvoorbeeld ook beïnvloed door de grootte en elektronegativiteit van het atoom.
Voorbeelden:
* ijzer (Fe) heeft vier ongepaarde elektronen en is een relatief hard metaal.
* chroom (CR) heeft zes ongepaarde elektronen en is een zeer hard metaal.
* koper (cu) heeft één ongepaard elektron en is een zachter metaal.
Conclusie:
Hoewel het aantal ongepaarde elektronen een nuttige indicator van hardheid in overgangsmetalen kan zijn, is het geen definitieve factor. Verschillende andere factoren moeten worden overwogen voor een volledig begrip van de hardheid.
 Bacteriën werven om katalysatoren atoom voor atoom te bouwen
Bacteriën werven om katalysatoren atoom voor atoom te bouwen Waarom zijn vloeistoffen en vaste stoffen niet samendrukbaar?
Waarom zijn vloeistoffen en vaste stoffen niet samendrukbaar?  Wat als er 8 protonen in een atoom zitten, hoeveel elektronen zijn dat dan?
Wat als er 8 protonen in een atoom zitten, hoeveel elektronen zijn dat dan?  Een mineralenhardheid ten opzichte van andere kan worden bepaald door?
Een mineralenhardheid ten opzichte van andere kan worden bepaald door?  Is een niet -verbogenbare fysische of chemische eigenschap?
Is een niet -verbogenbare fysische of chemische eigenschap?
 Welk type oceaanzone doen palingen live?
Welk type oceaanzone doen palingen live?  Wat betekent beleggen met tropisch weer?
Wat betekent beleggen met tropisch weer?  Welke wetenschap zoekt kennis in plaats van toepassing?
Welke wetenschap zoekt kennis in plaats van toepassing?  De wereld kijkt toe terwijl Californië een controversieel plan overweegt om tropische bossen te redden
De wereld kijkt toe terwijl Californië een controversieel plan overweegt om tropische bossen te redden 250, 000 inwoners van Melbourne verliezen water door houtkap
250, 000 inwoners van Melbourne verliezen water door houtkap
Hoofdlijnen
- Neuronen die zijn gewikkeld in een vetmembraan zijn?
- Een incubator laten groeien Bacteriën
- Een wortel is een voorbeeld van een?
- Welk deel van een dierencel is vergelijkbaar met je huid?
- De kaken van woestijnsprinkhanen scherpen zichzelf, ontdekt materiaalwetenschapper
- Hebben alle levende wezens celwanden als buitengrens?
- Hoe tarwe de evolutionaire strijd tegen zijn dodelijke schimmelvijand verloor
- Welke kleurenbuis wordt gebruikt om lipase te tekenen?
- Wat zijn draagvloeistoffen van de wortels tot bladeren van vasculaire planten?
- Nieuwe isolatietechniek maakt de weg vrij voor krachtigere en kleinere spanen
- Nieuw membraan van twee polymeer verhoogt de prestaties van waterstofbrandstofcellen

- Nieuw model meet kenmerken van koolstofnanobuisstructuren voor toepassingen voor energieopslag en waterontzilting

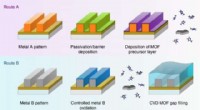
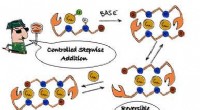
- Moleculaire draden bouwen, één atoom tegelijk
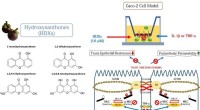
- Replicatie van extract van mangosteenschil als behandeling voor darmontsteking bij mens en dier
 ECOSTRESS lanceert naar ruimtestation op SpaceX-missie
ECOSTRESS lanceert naar ruimtestation op SpaceX-missie Wil je de klimaatverandering ‘zien’? Controleer uw thermometer
Wil je de klimaatverandering ‘zien’? Controleer uw thermometer  Extreme regenval waarschijnlijker door klimaatverandering
Extreme regenval waarschijnlijker door klimaatverandering Hoe de vierkante voet van een onregelmatige veelhoek berekenen
Hoe de vierkante voet van een onregelmatige veelhoek berekenen Chinese Robotic Sub ziet eruit als een clownvis
Chinese Robotic Sub ziet eruit als een clownvis  Wanneer speelt de maan bij zonsopgang in het westen?
Wanneer speelt de maan bij zonsopgang in het westen?  Nanomaterialen synthetiseren uit blauwdrukken van de natuur
Nanomaterialen synthetiseren uit blauwdrukken van de natuur  Gebruik maken van de ratelende beweging van zuurstofionen om T-stralen om te zetten in zichtbaar licht
Gebruik maken van de ratelende beweging van zuurstofionen om T-stralen om te zetten in zichtbaar licht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

