
Wetenschap
Hebben groep één metalen een hoog smeltpunt?
Dit is waarom:
* Zwakke metalen binding: Metalen van groep 1 hebben slechts één valentie -elektron dat ze bijdragen aan de metalen binding. Dit resulteert in zwakke metalen binding in vergelijking met andere metalen.
* Grote atoommaat: Alkali -metalen hebben grote atoomstralen, wat betekent dat het buitenste elektron verder van de kern is en er minder sterk tot aangetrokken is. Dit draagt bij aan zwakkere binding.
* elektropositiviteit: Ze zijn zeer elektropositief, wat betekent dat ze gemakkelijk hun valentie -elektron verliezen. Dit verzwakt verder de metalen binding.
Voorbeeld:
* Lithium (Li) heeft een smeltpunt van 180,5 ° C.
* Natrium (NA) heeft een smeltpunt van 97,79 ° C.
* Kalium (K) heeft een smeltpunt van 63,5 ° C.
Terwijl u de groep afloopt, nemen de smeltpunten af als gevolg van de toenemende atoomgrootte en zwakkere metalen binding.
 Onderzoekers wijzen uit hoe bomen een rol spelen bij de smogproductie
Onderzoekers wijzen uit hoe bomen een rol spelen bij de smogproductie  Het verbranden van aardgas is nu gevaarlijker dan steenkool in Illinois, studie toont
Het verbranden van aardgas is nu gevaarlijker dan steenkool in Illinois, studie toont Wat is het moeilijkste natuurlijke materiaal?
Wat is het moeilijkste natuurlijke materiaal?  Voorbeelden van stof door vulkaanuitbarstingen die de zon blokkeren
Voorbeelden van stof door vulkaanuitbarstingen die de zon blokkeren Van huisdieren tot ongedierte:hoe tamme konijnen de wildernis overleven
Van huisdieren tot ongedierte:hoe tamme konijnen de wildernis overleven
Hoofdlijnen
- Hoe u een mRNA-reeks kunt berekenen
- Data-ethiek is meer dan alleen wat we met data doen, het gaat ook over wie het doet
- Waarom zijn er geen dieren met drie poten?
- Wat is de genetische aard van gerimpelde fenotype erwtenzaden?
- Wat beschrijft correct een verschil tussen de mannelijke en vrouwelijke voortplantingssystemen?
- Cowbird-kuikens doen het het beste met twee grasmusnesten - niet vier, niet nul, studievondsten
- Onderzoekers ontsluiten hoe cellen hun functies bepalen
- Wie zijn allemaal cytologen en hun bijdrage?
- Welke organellen bevatten enzymen die worden gebruikt bij de afbraak van glucose en generatie ATP?
- Koper en PTFE blijven bij elkaar om betere 5G te ondersteunen

- Bevindingen bevestigen het vermogen van beeldvormende technieken om gezond weefsel te onderscheiden na neoadjuvante chemotherapie
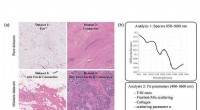
- Biochemici ontrafelen mysteries van cellulaire vorm, functie

- Onderzoekers ontdekken de kunst van het feilloos printen van extreem harde staalsoorten
- Elektronenbewegingen in vloeistof gemeten in superslow motion

 Wat is de formule voor magnesiumwaterstof vertellend?
Wat is de formule voor magnesiumwaterstof vertellend?  Wat is de belangrijkste energiebron voor sterren?
Wat is de belangrijkste energiebron voor sterren?  Wat is de naam van Ionic Compound CR2S3?
Wat is de naam van Ionic Compound CR2S3?  Lang en smal, vrij van gebreken, en oplosbaar:grafeen nanoribbons door bottom-up synthese
Lang en smal, vrij van gebreken, en oplosbaar:grafeen nanoribbons door bottom-up synthese Wondgenezende biomaterialen activeren het immuunsysteem voor een sterkere huid
Wondgenezende biomaterialen activeren het immuunsysteem voor een sterkere huid Middle Earth bewaard in gigantische vogelpoep
Middle Earth bewaard in gigantische vogelpoep Gemanipuleerde E. coli kan koolhydraten maken, hernieuwbare brandstof, van CO2
Gemanipuleerde E. coli kan koolhydraten maken, hernieuwbare brandstof, van CO2 Welk woord is Quackenbush dat ervoor zorgt dat Gene vecht?
Welk woord is Quackenbush dat ervoor zorgt dat Gene vecht?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

