
Wetenschap
Welk model van een koolwaterstof toont het geometriemolecuul?
1. Structurele formules: Deze tonen de connectiviteit van atomen, maar geven niet expliciet de 3D -opstelling weer.
2. Ball-and-stick modellen: Deze gebruiken bollen om atomen en stokken weer te geven om bindingen weer te geven. Ze bieden een betere visuele weergave van de vorm van het molecuul, inclusief bindingshoeken.
3. Space-vulmodellen: Deze gebruiken bollen om atomen weer te geven en de bollen worden geschaald om de relatieve afmetingen van de atomen weer te geven. Dit model geeft een goed begrip van de algehele vorm en hoe atomen ruimte vullen in het molecuul.
4. Moleculaire orbitale diagrammen: Deze zijn complexer en tonen de interacties tussen atomaire orbitalen om moleculaire orbitalen te vormen. Deze weergave helpt de elektronische structuur te begrijpen en hoe deze de geometrie van het molecuul beïnvloedt.
5. Computermodellen: Software zoals ChemDraw, Spartan of Gaussian kan 3D -modellen genereren die kunnen worden geroteerd en gemanipuleerd om de geometrie van het molecuul vanuit verschillende hoeken te visualiseren.
Voorbeelden:
* methaan (CH4): Dit is een tetraëdrisch molecuul. Je kunt dit zien in een bal-en-stick model, waar het koolstofatoom zich in het midden bevindt en de vier waterstofatomen zich aan de hoeken van een tetraëder bevinden.
* Eteen (C2H4): Dit heeft een vlakke structuur met een dubbele binding tussen de twee koolstofatomen. Space-vullende modellen en moleculaire orbitale diagrammen kunnen dit illustreren.
* benzeen (C6H6): Dit heeft een ringstructuur met afwisselende enkele en dubbele bindingen. Een combinatie van ball-and-stick en ruimtevullende modellen kan een goede weergave van de geometrie geven.
Uiteindelijk hangt het beste model voor het visualiseren van de geometrie van een koolwaterstof af van het specifieke molecuul en de informatie die u wilt overbrengen.
 Piëzo-elektrisch verbeterde pn-overgangen in foto-elektrochemische systemen
Piëzo-elektrisch verbeterde pn-overgangen in foto-elektrochemische systemen  Wat heeft geen invloed op de snelheid waarmee een vaste opgeloste stof oplost?
Wat heeft geen invloed op de snelheid waarmee een vaste opgeloste stof oplost?  Wat is heterogene katalyse en oppervlaktewetenschappelijke groep?
Wat is heterogene katalyse en oppervlaktewetenschappelijke groep?  De natuur heeft meer dan één manier om methaan te maken, zeggen biochemici
De natuur heeft meer dan één manier om methaan te maken, zeggen biochemici Wat is de chemische formule voor natrium en chloor?
Wat is de chemische formule voor natrium en chloor?
Hoofdlijnen
- Studie biedt gedetailleerd inzicht in het vroege leven van grijze zeehondenpups op zee
- Wat is wetenschapsdama?
- Wat zijn de toepassing en theorieën in verschillende takken wetenschap?
- Hoe zeewiervretende krabben koraalriffen kunnen helpen redden
- Verborgen of uitgestorven? Genoomanalyse van een 120 jaar oud exemplaar van torpedorog bevestigt de status van de soort
- Sleutel tot betere asperges geïdentificeerd in evolutie van geslachtschromosomen
- Waarom is UV-licht schadelijk?
- Wat is de functie van flagella in een cel?
- Wat vormt een selectief permeabel membraan?
- Een nieuwe manier om pompoenkruiden te maken, verdovende middelen, cosmetica

- Op mosselen geïnspireerde lijm kan op een dag foetale chirurgie veiliger maken

- Wetenschappers stellen nieuwe benadering voor om atomen te meten

- Onderzoekers ontwikkelen goedkoper, snellere test op E. coli in drinkwater

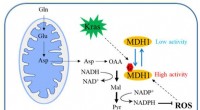
- Wetenschappers identificeren O-GlcNAcylatie als oorzaak van pancreastumorgroei door MDH1 te reguleren
 Emissiedoelen:Als er een (politieke) wil is, er is een manier
Emissiedoelen:Als er een (politieke) wil is, er is een manier Hoeveel mol natriumsulfaat zijn aanwezig in 0,1000 gram de verbinding?
Hoeveel mol natriumsulfaat zijn aanwezig in 0,1000 gram de verbinding?  Kunnen we gender waarnemen aan de hand van kinderstemmen?
Kunnen we gender waarnemen aan de hand van kinderstemmen? Hoeveel lichtjaren zijn er in sterren die je hemel?
Hoeveel lichtjaren zijn er in sterren die je hemel?  Helpt het natuurbehoud door een prijs op de natuur te zetten?
Helpt het natuurbehoud door een prijs op de natuur te zetten?  Californië leidt op het gebied van duurzaamheidsinnovatie terwijl Trump steenkool graaft
Californië leidt op het gebied van duurzaamheidsinnovatie terwijl Trump steenkool graaft Wat is -50 graden F in C?
Wat is -50 graden F in C?  Hoe beïnvloedt de afstand tussen objecten de zwaartekracht?
Hoe beïnvloedt de afstand tussen objecten de zwaartekracht?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

