
Wetenschap
Hoe lossen watermoleculen op in water?
de unieke eigenschappen van het water:
* polariteit: Watermoleculen zijn polair, wat betekent dat ze een enigszins positief uiteinde hebben (nabij de waterstofatomen) en een enigszins negatief uiteinde (nabij het zuurstofatoom). Deze polariteit creëert een sterke aantrekkingskracht tussen watermoleculen.
* waterstofbinding: De enigszins positieve waterstofatomen van één watermolecuul worden aangetrokken door de enigszins negatieve zuurstofatomen van aangrenzende watermoleculen. Deze attracties worden waterstofbruggen genoemd.
Hoe watermoleculen op elkaar inwerken:
1. Waterstofbinding: De waterstofbindingen tussen watermoleculen creëren een sterk netwerk van onderling verbonden moleculen.
2. Constante beweging: Deze moleculen bewegen, roteren en trillen constant.
3. Dynamisch evenwicht: De waterstofbindingen vormen zich voortdurend en breken, maar er zijn altijd meer waterstofbruggen aanwezig dan niet. Dit creëert een dynamisch evenwicht, waarbij de bindingen de watermoleculen bij elkaar houden in een vloeibare toestand.
Denk er zo aan:
Stel je een menigte mensen voor op een feestje voor. Iedereen beweegt constant en praat met elkaar. Soms paren mensen even weg, maar dan breken ze uit elkaar en gaan ze verder om met iemand anders te praten. Het algemene effect is dat er veel beweging en interactie is, maar er zijn altijd paren mensen die op een bepaald moment praten.
Dus, watermoleculen "oplossen" niet in water; Ze interageren door waterstofbinding, waardoor een constant verschuivend netwerk ontstaat dat water zijn unieke eigenschappen geeft.
 In kleine dorpsgemeenschappen, lokale hulpbronnen worden vaak niet duurzaam gebruikt
In kleine dorpsgemeenschappen, lokale hulpbronnen worden vaak niet duurzaam gebruikt De buitengewone terugkeer van zeeotters naar Glacier Bay
De buitengewone terugkeer van zeeotters naar Glacier Bay Tyfoon Shanshan klemt Japanse kust vast, Tokio sparen
Tyfoon Shanshan klemt Japanse kust vast, Tokio sparen Klimaatverandering kan landbouwgrond vergroten
Klimaatverandering kan landbouwgrond vergroten Primaire tropische bossen zijn het beste, maar hergroeiende bossen zijn ook van vitaal belang voor de biodiversiteit
Primaire tropische bossen zijn het beste, maar hergroeiende bossen zijn ook van vitaal belang voor de biodiversiteit
Hoofdlijnen
- Worden wetenschappelijke ontdekkingen aangestuurd door geweldige individuen of teams?
- Wat zijn de cellen gevormd in vrouwelijke reproductieve organen die opgeslagen voedsel bevatten?
- De vijand binnenin:hoe ziekteverwekkers zich ongemerkt in het lichaam verspreiden
- Welk systeem regelt de ademhaling?
- Wat is de hoeveelheid genen in een dierencel?
- Wat is een zaadpod?
- Wat zijn de bouwstenen van dit biomolecuul Amylase?
- Welke cel is ongeorganiseerd?
- Hoe werken organellen in prokaryotische cellen samen?
- Ontwikkeling van een nieuwe methode voor het synthetiseren van dialkylethers met behulp van drie katalysatoren die alkenen hydroxyleren
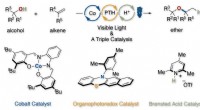
- Een geleidend alternatief voor koper koken met aluminium

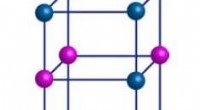
- Opvallen:ongebruikelijke magnetische overgang in perovskietoxide kan spintronica helpen stimuleren
- Onderzoekers maken de eerste kaarten van twee melatoninereceptoren die essentieel zijn voor slaap
- Verbindingen in een Aziatische gefermenteerde vispasta kunnen een hoog cholesterolgehalte verlagen

 Onderzoek van bergen afgebeeld in Tableau Physique onthult fouten, impact van klimaatverandering
Onderzoek van bergen afgebeeld in Tableau Physique onthult fouten, impact van klimaatverandering Zeewaterdoorbraak in productie van klimaatvriendelijke brandstof bio-ethanol verlaagt vraag naar zoetwater
Zeewaterdoorbraak in productie van klimaatvriendelijke brandstof bio-ethanol verlaagt vraag naar zoetwater Deskundige ziektedetective ontrafelt mysterieuze ziekte die de beroemde 12e-eeuwse sultan heeft gedood
Deskundige ziektedetective ontrafelt mysterieuze ziekte die de beroemde 12e-eeuwse sultan heeft gedood Wat zijn de meest primitieve organismen die tegenwoordig een structuur hebben die te simpel is als cellen.?
Wat zijn de meest primitieve organismen die tegenwoordig een structuur hebben die te simpel is als cellen.?  De basis leggen voor autonome transportnetwerken
De basis leggen voor autonome transportnetwerken Studie:ouders zijn van cruciaal belang voor de manier waarop we met stress omgaan
Studie:ouders zijn van cruciaal belang voor de manier waarop we met stress omgaan  Kun je een omvormer gebruiken om 12V lier te voeden?
Kun je een omvormer gebruiken om 12V lier te voeden?  Conische nanokoolstofstructuren kunnen leiden tot flexibele, transparante veldemissiedisplays
Conische nanokoolstofstructuren kunnen leiden tot flexibele, transparante veldemissiedisplays
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

