
Wetenschap
Wat is de edelgaselektronenconfiguratie van strontiumfluoride?
1. Identificeer de elementen en hun kosten:
* strontium (sr) is in groep 2, dus het verliest 2 elektronen om Sr²⁺ te vormen.
* fluor (f) is in groep 17, dus het krijgt 1 elektron om F⁻ te vormen.
2. Bepaal de elektronenconfiguraties:
* strontium (SR): [KR] 5S²
* Sr²⁺ verliest zijn 2 valentie -elektronen:[KR]
* fluor (f): [Hij] 2s² 2p⁵
* F⁻ wint 1 elektron om zijn P orbital te vullen:[He] 2S² 2p⁶ =[ne]
3. Combineer de configuraties:
Omdat we twee fluorionen (F⁻) hebben voor elk strontiumion (Sr²⁺), is de uiteindelijke edelgaselektronenconfiguratie voor strontium fluoride:
[kr] + 2 [ne]
Daarom is de adellijke gaselektronenconfiguratie van strontiumfluoride [KR] 2 [NE].
 Ontwikkeld materiaal dat tegelijkertijd warmte-isolerend en warmtegeleidend is
Ontwikkeld materiaal dat tegelijkertijd warmte-isolerend en warmtegeleidend is Hoe zou u het hoofd chloride scheiden van het mengsel van en zilveren chloride?
Hoe zou u het hoofd chloride scheiden van het mengsel van en zilveren chloride?  De moord op sekswerkers in Johannesburg laat zien waarom Zuid-Afrika de handel dringend moet decriminaliseren
De moord op sekswerkers in Johannesburg laat zien waarom Zuid-Afrika de handel dringend moet decriminaliseren  Wat is de eindtemperatuur van water als er een metaal in daalde?
Wat is de eindtemperatuur van water als er een metaal in daalde?  Wat zijn de 3 belangrijkste gassen in de lucht?
Wat zijn de 3 belangrijkste gassen in de lucht?
 Cryovulkanisme:waarom bestuderen? Wat kan het ons leren over het vinden van leven buiten de aarde?
Cryovulkanisme:waarom bestuderen? Wat kan het ons leren over het vinden van leven buiten de aarde?  De Californische senator Blakespear zegt dat de kustspoorlijn zich op een klimaatkruispunt bevindt
De Californische senator Blakespear zegt dat de kustspoorlijn zich op een klimaatkruispunt bevindt  Innovatief GEDI-instrument verzamelt nu bosgegevens
Innovatief GEDI-instrument verzamelt nu bosgegevens Ontbossing in de Amazone heeft een aanzienlijke impact op het lokale klimaat in Brazilië
Ontbossing in de Amazone heeft een aanzienlijke impact op het lokale klimaat in Brazilië Antropogene warmteflux verhoogt de frequentie van extreme hitte-gebeurtenissen
Antropogene warmteflux verhoogt de frequentie van extreme hitte-gebeurtenissen
Hoofdlijnen
- Wat voor soort dier eet boomgaardgras?
- Goede hond of slechte hond? Nieuwe studie toont aan dat ras niet echt een voorspeller is van gedrag
- Welke structuren worden voornamelijk gevonden in de Palisade -laag van Mesophyll?
- Wat is het gedeelte van een enzymmolecuul waarin een specifiek substraat kan passen, de?
- Wat is anaërobe ademhaling en geef twee voorbeelden van ademhaling?
- Wat zijn menselijke eters?
- Biologen ontdekken hoe virussen de machinerie van cellen kapen
- Wetenschappers tonen universaliteit aan in de evolutie van de hersenen
- Wat voor soort wetenschapper bestudeert libellen?
- Venetiaanse arts speelde een sleutelrol bij het vormgeven van vroegmoderne chemie

- Micro-organismen bouwen de beste brandstofefficiënte waterstofcellen
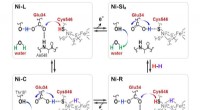
- Lab creëert stoere, maar teder, kankerbestrijders
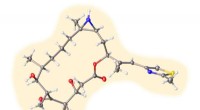
- Ontworpen eiwitschakelaar zorgt voor ongekende controle over levende cellen

- Video:De vreemde chemie die meesterwerken bedreigt

 Zijn kalkputten constructief of destructief?
Zijn kalkputten constructief of destructief?  Verbindingen met het grootste ionische karakter zouden zich vormen als fluor reageert met?
Verbindingen met het grootste ionische karakter zouden zich vormen als fluor reageert met?  Hoeveel ons is er in 6 ml?
Hoeveel ons is er in 6 ml?  Een pad naar nieuwe nanofluïdische apparaten die spintronica-technologie toepassen
Een pad naar nieuwe nanofluïdische apparaten die spintronica-technologie toepassen Huishoudfenomeen waargenomen door Leonardo da Vinci eindelijk uitgelegd
Huishoudfenomeen waargenomen door Leonardo da Vinci eindelijk uitgelegd Ryanair-vliegtuigen gaan de lucht in ondanks Europese stakingen
Ryanair-vliegtuigen gaan de lucht in ondanks Europese stakingen Wat doet een chemische stof? Misvattingen over scheikunde aanpakken
Wat doet een chemische stof? Misvattingen over scheikunde aanpakken Brug tussen kwantummechanica en algemene relativiteitstheorie nog steeds mogelijk
Brug tussen kwantummechanica en algemene relativiteitstheorie nog steeds mogelijk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

