
Wetenschap
Micro-organismen bouwen de beste brandstofefficiënte waterstofcellen
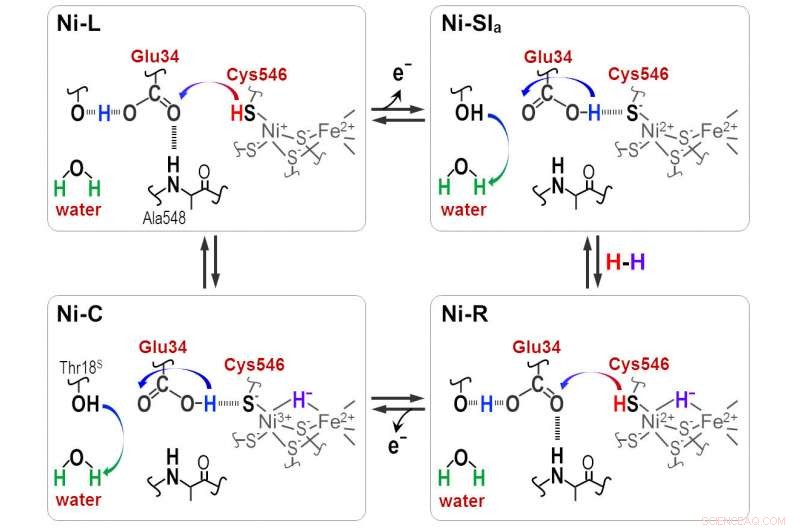
Protonen worden tijdens de katalytische reactie van [NiFe]-hydrogenase overgedragen tussen de NiFe-actieve plaats en het omringende eiwit via de Cyt546- en Glu34-residuen. Krediet:Shun Hirota
Voor alle vooruitgang die de technologie in ons leven heeft geboekt, in veel gevallen staat het achter wat de natuur kan doen. Mieren kunnen 5000 keer hun gewicht dragen, en spinnenwebben zijn vijf keer sterker dan staal. Brandstofefficiëntie is niet anders. In een nieuwe stud in Internationale editie van Angewandte Chemie , onderzoekers van het Nara Institute of Science and Technology (NAIST) rapporteren nieuwe details over de protonoverdrachtsroute van nikkel-ijzer [NiFe]-hydrogenase met behulp van Fourier-transformatie-infraroodspectroscopie (FTIR). Deze overdracht is cruciaal voor het waterstofmetabolisme van micro-organismen, en de studie geeft wetenschappers een beter begrip van hoe ze de natuur kunnen nabootsen bij de constructie van nieuwe biobrandstofcellen.
Waterstofmetabolisme is een van de oudste vormen van energieproductie voor het leven en een van de meest intensief bestudeerde vanwege de betekenis ervan in de evolutie. Het heeft ook de aandacht getrokken omdat het een schone energiebron is. Onder de enzymen die verantwoordelijk zijn voor het waterstofmetabolisme, [NiFe]-hydrogenase is de meest voorkomende en oudste.
Er is veel bekend over het enzym. Het oxideert omkeerbaar waterstofatomen via zijn Ni-Fe actieve plaats, die is omgeven door specifieke aminozuren. Echter, merkt NAIST-professor Shun Hirota op, die de studie leidde, bepaalde fundamenten in de chemische reacties moeten worden begrepen voordat deze nanomachine wordt gebruikt om biobrandstoftechnologieën te ontwerpen.
"Hydride en proton coördineren met de Ni-Fe-site in de protonatie-deprotonatiecyclus, resulterend in vier hydrogenasetoestanden. Maar de protonoverdrachtsroute blijft onbekend, " hij zegt.
Een reden voor het gebrek aan duidelijkheid is het onvermogen om de rekfrequenties van verschillende waterstofbruggen op te lossen. In het nieuwe werk Het Hirota-team, in samenwerking met andere onderzoekers in Japan en China, loste dit probleem op door fotoconversies van drie hydrogenasetoestanden te observeren met FTIR-spectra.
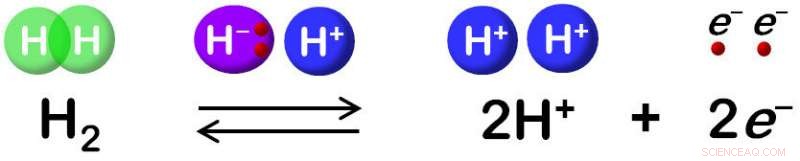
Hydrogenase katalyseert de omkeerbare oxidatie van H2. Krediet:Shun Hirota
Duidelijke absorptiefrequenties onthulden dat een van de vier cysteïnes, cysteïne 546, samen met een ander aminozuur, glutaminezuur 34, en een geordend watermolecuul zijn cruciaal voor de overdracht. De wetenschappers gebruikten de nieuwe informatie om af te leiden hoe het zwavelmolecuul van cysteïne 546 en de zuurgroep in glutaminezuur 34 waterstofbruggen vormen om het waterstoftransport te reguleren.
"Onze resultaten laten zien dat cysteïne 546 een protondonor en -acceptor is in de [Ni-Fe]-hydrogenasecyclus. Ze laten ook zien hoe een waterstofbrug met een lage barrière voor glutaminezuur 34 wordt gevormd en gesplitst tijdens de katalytische cyclus, " merkt Hirota op.
Micro-organismen hebben zich aangepast aan een breder scala aan omgevingsomstandigheden dan mensen. Ze zijn te vinden in het comfortabele klimaat van onze slaapkamers tot de meest vijandige omgevingen op aarde. Dus, zien hoe de [Ni-Fe]-plaats van [Ni-Fe]-hydrogenase protonen optimaal overdraagt, biedt een paradigma voor onderzoekers die onder een groot aantal omstandigheden energiekatalysatoren met een hoog rendement willen maken.
"Het leven heeft miljarden jaren besteed aan het aanpassen aan energie. We geloven dat dit ons het beste model geeft voor energie-efficiëntie in de toekomst, ' zegt Hirota.
 Ruwe oppervlakken bieden extra locaties voor energieopwekkende reacties in brandstofcellen
Ruwe oppervlakken bieden extra locaties voor energieopwekkende reacties in brandstofcellen Eenvoudige experimenten voor de relatie tussen diffusie en temperatuur
Eenvoudige experimenten voor de relatie tussen diffusie en temperatuur  Chemicus synthetiseert ijzercoördinatiepolymeer met nicotinezuurderivaat
Chemicus synthetiseert ijzercoördinatiepolymeer met nicotinezuurderivaat In enkele seconden vlees- en visfraude aan het licht brengen met een draagbare MasSpec-pen
In enkele seconden vlees- en visfraude aan het licht brengen met een draagbare MasSpec-pen Breedspectrum NLO-materialen verkregen door polykation-substitutie-geïnduceerde NLO-functionele motiefordening
Breedspectrum NLO-materialen verkregen door polykation-substitutie-geïnduceerde NLO-functionele motiefordening
 Bordeaux hoopt op verwoeste wijngaarden in junibloei
Bordeaux hoopt op verwoeste wijngaarden in junibloei Nieuw voorspellingssysteem waarschuwt inwoners van New Delhi over ongezonde lucht
Nieuw voorspellingssysteem waarschuwt inwoners van New Delhi over ongezonde lucht Afbeelding:harde wind, warm weer blijft branden in Californië aanwakkeren
Afbeelding:harde wind, warm weer blijft branden in Californië aanwakkeren Waar gaat al die koolstofdioxide heen?
Waar gaat al die koolstofdioxide heen? Gefossiliseerde bladwas van planten biedt een nieuw hulpmiddel om oude klimaten te begrijpen
Gefossiliseerde bladwas van planten biedt een nieuw hulpmiddel om oude klimaten te begrijpen
Hoofdlijnen
- Waar vindt transcriptie plaats in een eukaryote cel?
- Feiten over de wortelcellen van planten
- Kwam Eiwit, DNA of RNA als eerste?
- Wat zijn de belangrijkste functies van microtubules in de cel?
- Hoe zijn fotosynthese en cellulaire ademhaling gerelateerd?
- Zelfs koude harde contanten zijn niet genoeg stimulans om naar tegengestelde meningen te luisteren
- Wat is de formule voor cellulaire ademhaling?
- Tips voor bedwantsen voor vakantiereizigers
- Amerikaans sage hoenbeleid keert terug naar af
- Schelpen en grapefruits inspireren het eerste vervaardigde niet-snijbare materiaal

- Vloeibare metalen de geheime ingrediënten om het milieu schoon te maken

- Onderzoekers ontdekken nieuw mechanisme van antibioticaresistentie bij lepra en tuberculose
- Wetenschappers gebruiken machine learning om hoogwaardige zonnematerialen te identificeren

- Verbrande botten weer tot leven brengen met behulp van 3D-technologie

 Hoe stoomgeneratoren werken
Hoe stoomgeneratoren werken  Geheimen van de overdracht van COVID-19 onthuld in turbulente trekjes
Geheimen van de overdracht van COVID-19 onthuld in turbulente trekjes Nieuwe fotonentellende camera legt 3D-beelden vast met opnamesnelheid en resolutie
Nieuwe fotonentellende camera legt 3D-beelden vast met opnamesnelheid en resolutie De luchtkwaliteit is sinds 2016 verslechterd, geassocieerd met meer vroegtijdige sterfgevallen in de VS
De luchtkwaliteit is sinds 2016 verslechterd, geassocieerd met meer vroegtijdige sterfgevallen in de VS Math-problemen in Algebra doen 1
Math-problemen in Algebra doen 1  Wat gebeurt er na verdamping van waterdamp?
Wat gebeurt er na verdamping van waterdamp?  De verwarming staat aan voor oplaadbare natrium-mangaanoxide-batterijen
De verwarming staat aan voor oplaadbare natrium-mangaanoxide-batterijen Hoe SLPM naar SCFM te converteren
Hoe SLPM naar SCFM te converteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

