
Wetenschap
Wat is de pH van waterstofperoxide?
Dit is waarom:
* dissociatie: Hoewel H₂o₂ een zwak zuur is, dissocieert het gedeeltelijk in water, waardoor een kleine hoeveelheid waterstofionen (H⁺) vrijgeeft:
H₂o₂ ⇌ H⁺ + ho₂⁻
* pH -impact: De aanwezigheid van deze waterstofionen maakt de oplossing enigszins zuur.
De exacte pH van waterstofperoxide hangt af van de concentratie ervan. Een oplossing van 3% (vaak aangetroffen in drogisterijen) heeft meestal een pH rond 6,5. Meer geconcentreerde oplossingen zullen echter zuurder zijn.
Belangrijke opmerking: Waterstofperoxide is een reactieve verbinding en moet met zorg worden behandeld. Raadpleeg altijd naar de veiligheidsinformatie van het product.
Hoofdlijnen
- Wat doodde de dinosaurussen?
- Wat is superieur DNA?
- Wat zijn lytische enzymen?
- Welk zoogdier heeft 9neck vertibrae?
- Wat is het voorbeeld van hydrofyten?
- Welk organel met een reeks membraankanalen mist ribosomen, maar produceert lipiden voor de cel?
- Wat is het beste weefsel om DNA te extraheren?
- Wat is een gedrag dat genetisch bepaald en niet kan worden gewijzigd?
- Welke 2 reactanten zijn vereist voor cellulaire ademhaling?
- Studie:Nieuw oplosmiddelvrij, enkel lithium-ion geleidend covalent organisch raamwerk
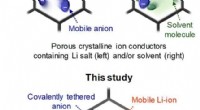
- Onderzoek naar de dynamiek van de vorming van nanodeeltjes uit een voorloper met atomaire resolutie

- Keramische honingraatluchtfilters kunnen stadsvervuiling verminderen

- Wetenschappelijke vooruitgang kan het gemakkelijker maken om plastic te recyclen

- Neutronen observeren vitamine B6-afhankelijke enzymactiviteit die nuttig is voor de ontwikkeling van geneesmiddelen
 Van groepsimmuniteit en zelfgenoegzaamheid tot groepspaniek:hoe vaccinatieangst zich ontvouwt
Van groepsimmuniteit en zelfgenoegzaamheid tot groepspaniek:hoe vaccinatieangst zich ontvouwt  NASA-nachtbeeld toont orkaan Paulettes met grote ogen naderen Bermuda
NASA-nachtbeeld toont orkaan Paulettes met grote ogen naderen Bermuda Waar zijn alle schelpen gebleven?
Waar zijn alle schelpen gebleven?  Onderzoekers kijken om hoeken om objectvormen te detecteren
Onderzoekers kijken om hoeken om objectvormen te detecteren Onderzoekers passen temperatuurgradiënten toe om vloeibare kristallen te laten groeien en verplaatsen
Onderzoekers passen temperatuurgradiënten toe om vloeibare kristallen te laten groeien en verplaatsen Innovatieve detectoren lokaliseren snel de stralingsbron
Innovatieve detectoren lokaliseren snel de stralingsbron Enorme protoster blijft groeien ondanks ionisatieverwarming door ultraviolet licht
Enorme protoster blijft groeien ondanks ionisatieverwarming door ultraviolet licht Nieuwe tool voor modellen energiesector CO2-afvangstimulansen
Nieuwe tool voor modellen energiesector CO2-afvangstimulansen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


