
Wetenschap
Neutronen observeren vitamine B6-afhankelijke enzymactiviteit die nuttig is voor de ontwikkeling van geneesmiddelen
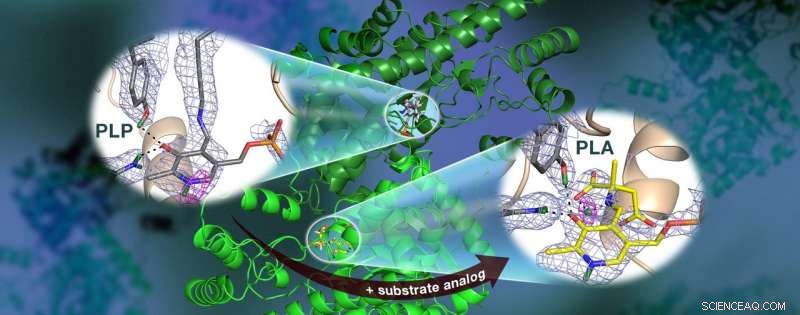
Een door ORNL geleid team gebruikte neutronen om het AAT-enzym te observeren, een vitamine B6-afhankelijk eiwit, en ontdekte dat de chemische reactie slechts op één actieve plaats plaatsvond. Nucleaire verstrooiingslengtedichtheidskaarten (gekleurd gaas) markeren de posities van kritieke waterstofatomen, inclusief een waterstofbrug met lage barrière (magenta mesh) waarvan wordt aangenomen dat deze niet bestaat in AAT, die cruciaal kunnen zijn voor katalyse. Krediet:Jill Hemman en Andrey Kovalevsky / Oak Ridge National Laboratory, Amerikaanse Ministerie van Energie
Wetenschappers van het Oak Ridge National Laboratory van het Department of Energy hebben een structurele neutronenanalyse uitgevoerd van een vitamine B6-afhankelijk eiwit, potentieel openen van wegen voor nieuwe antibiotica en medicijnen voor de bestrijding van ziekten zoals resistente tuberculose, malaria en suikerziekte.
specifiek, het team gebruikte neutronenkristallografie om de locatie van waterstofatomen in aspartaataminotransferase te bestuderen, of AAT, een enzym dat essentieel is voor het metabolisme van bepaalde aminozuren.
"We visualiseerden de eerste neutronenstructuur van een vitamine B6-enzym dat behoort tot een grote eiwitfamilie met honderden leden die in de natuur voorkomen, " zei ORNL's Andrey Kovalevsky, een senior co-auteur van de studie, die werd gepubliceerd in Nature Communications.
Vitamine B6-afhankelijke eiwitten maken deel uit van een diverse groep enzymen die meer dan honderd verschillende chemische reacties in cellen uitvoeren. De enzymen zijn interessant voor biomedische, evenals bio-energie, onderzoekers vanwege hun rol bij het metaboliseren van aminozuren en andere celvoedingsstoffen.
"Deze enzymen zijn uniek omdat ze elk een specifieke chemische reactie uitvoeren met uitstekende nauwkeurigheid, terwijl andere levensvatbare chemische transformaties worden onderdrukt, " zei Kovalevsky. "Hoe ze dit bereiken, wordt niet goed begrepen, maar het is van groot belang voor het ontwerp van medicijnen."
Het eerdere onderzoek van het team voorspelde dat waterstofatomen in en rond de actieve plaats van het enzym bewegen, waar de chemische reactie plaatsvindt, wat aangeeft dat de positionering van de waterstofatomen het reactietype regelt. Het kennen van de precieze locatie van waterstofatomen kan verklaren waarom het gedrag van deze enzymen zo specifiek is, maar waterstof is moeilijk te detecteren met standaardmethoden zoals röntgenkristallografie.
Om de posities van waterstofatomen binnen AAT direct te bepalen, het ORNL-geleide team wendde zich tot neutronendiffractietechnieken. De onderzoekers stelden delicate eiwitkristallen bloot aan neutronen met behulp van de IMAGINE-bundellijn bij ORNL's High Flux Isotope Reactor en de LADI-III-bundellijn bij het Institut Laue-Langevin in Grenoble, Frankrijk.
Verrassend genoeg, het team observeerde een reactie binnen één AAT-eiwitbiomolecuul terwijl een ander AAT-biomolecuul onveranderd was, het verstrekken van een voor-en-na perspectief van de enzym-gekatalyseerde chemische reactie.

Steven Dajnowicz van ORNL (links) en Andrey Kovalevsky hebben een monster voorbereid om de structurele neutronenanalyse van een vitamine B6-afhankelijk eiwit te starten met behulp van de IMAGINE-bundellijn bij ORNL's High Flux Isotope Reactor. De resultaten van de studie zouden nieuwe antibiotica en medicijnen kunnen openen om ziekten te bestrijden. Krediet:Genevieve Martin/Oak Ridge National Laboratory, Amerikaanse Ministerie van Energie
"De gegevens onthulden dat in een van de biomoleculaire structuren van het enzym de covalente bindingen reorganiseerden nadat een chemische reactie plaatsvond in de actieve plaats en, in een andere, de reactie had niet plaatsgevonden, " zei Kovalevsky. "In wezen, we waren in staat om twee structuren in één kristal te verkrijgen, wat nog nooit eerder is gedaan voor een eiwit dat neutronen gebruikt."
Met deze kennis, het team zal moleculaire simulaties uitvoeren om het specifieke gedrag van de waterstofatomen te bepalen bij interactie met het enzym. De resultaten kunnen nuttig zijn bij het begeleiden van het toekomstige ontwerp van nieuwe geneesmiddelen tegen multiresistente tuberculose, malaria, diabetes en antibioticaresistente bacteriën.
"Deze studie benadrukt hoe neutronen een ongeëvenaarde sonde zijn voor het identificeren van de locatie van waterstofatomen in biologische systemen, ons voorzien van een ongekend niveau van structurele details voor dit belangrijke enzym, "Ladi-III beamline-wetenschapper Matthew Blakeley zei.
 NASA's volgen de grote orkaan Douglas in Hawaï
NASA's volgen de grote orkaan Douglas in Hawaï Geschillen over klimaatverandering groeien snel, zegt wereldwijde studie
Geschillen over klimaatverandering groeien snel, zegt wereldwijde studie Drie vragen die klimaatwetenschap moet beantwoorden
Drie vragen die klimaatwetenschap moet beantwoorden Fossil Hunting in Tennessee
Fossil Hunting in Tennessee bosbranden, houtkap beïnvloedt schimmels waarvan dennenbossen afhankelijk zijn om te overleven, onderzoeken tonen aan
bosbranden, houtkap beïnvloedt schimmels waarvan dennenbossen afhankelijk zijn om te overleven, onderzoeken tonen aan
Hoofdlijnen
- Tijger botten? Leeuw botten? Een bijna uitgestorven cycad? DNA-controles ter plaatse bij aankomsthavens
- Verloren Australische duiker zwom mijlen naar kust gestalkt door haai
- Studie vindt potentiële celreceptoren om antibioticaresistentie te verminderen
- Een epigenetische sleutel om gedragsverandering te ontgrendelen
- De celstructuur van een ui
- Welke organen maken het vaatstelsel op?
- Golgi-apparaat: functie, structuur (met analogie en diagram)
- Het verschil tussen rode en witte bloedcellen
- Wat gebeurt er in de interfase van de celcyclus?
- De tijd berekenen om water te verwarmen

- Technologie versnelt het proces om salmonella te detecteren, E coli, andere door voedsel overgedragen ziekten

- Geblokkeerde beweging in moleculaire motor en rotor

- Hoe isotopen te berekenen

- Ontdekking van een nieuwe structuurfamilie van oxide-ionengeleiders SrYbInO4

 Nieuwe geleidende polymeerinkt opent voor de volgende generatie gedrukte elektronica
Nieuwe geleidende polymeerinkt opent voor de volgende generatie gedrukte elektronica Gewone microben werken samen om polymeercomposieten af te breken
Gewone microben werken samen om polymeercomposieten af te breken Wolkenkrabbers in New York passen zich aan klimaatverandering aan
Wolkenkrabbers in New York passen zich aan klimaatverandering aan 200 jaar geleden, mensen ontdekten Antarctica - en begonnen de dieren te slachten tot bijna uitsterven voor winst
200 jaar geleden, mensen ontdekten Antarctica - en begonnen de dieren te slachten tot bijna uitsterven voor winst Team voert eerste laboratoriumsimulatie uit van atmosferische chemie van exoplaneten
Team voert eerste laboratoriumsimulatie uit van atmosferische chemie van exoplaneten AI identificeert verandering in microstructuur in verouderende materialen
AI identificeert verandering in microstructuur in verouderende materialen Bali vulkaan stoft resorts in as; Luchthaven Lombok gaat dicht
Bali vulkaan stoft resorts in as; Luchthaven Lombok gaat dicht Het gemakkelijker maken om 2D-schetsen in vrije vorm om te zetten in 3D-modellen
Het gemakkelijker maken om 2D-schetsen in vrije vorm om te zetten in 3D-modellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

