
Wetenschap
Waarom vormt koolstof een covalente binding?
* Elektronische configuratie: Koolstof heeft 4 valentie -elektronen (elektronen in de buitenste schaal). Het heeft nog 4 elektronen nodig om een stabiele octetconfiguratie te bereiken, zoals de edelgassen.
* elektronegativiteit: Koolstof heeft een matige elektronegativiteit. Het is niet sterk genoeg om elektronen weg te trekken van andere atomen om ionische bindingen te vormen, noch is het zwak genoeg om zijn eigen elektronen gemakkelijk te verliezen.
Waarom covalente bindingen de oplossing zijn:
* delen is zorgzaam: Covalente bindingen laten koolstof toe om zijn 4 valentie -elektronen te delen met andere atomen, het voltooien van zijn octet en het bereiken van stabiliteit.
* Sterke bindingen: Covalente bindingen zijn relatief sterk, wat leidt tot stabiele moleculen.
* veelzijdigheid: Het vermogen om 4 covalente bindingen te vormen, zorgt ervoor dat koolstof een enorme verscheidenheid aan complexe moleculen creëert, waardoor de ruggengraat van organische chemie en leven zelf wordt gevormd.
Samenvattend: De elektronische configuratie en elektronegativiteit van koolstof maken het ideaal voor het vormen van sterke, stabiele covalente bindingen, waardoor het de enorme en diverse reeks organische verbindingen kan creëren die we overal om ons heen zien.
 Welke factoren hebben de meeste invloed op de diffusiesnelheid in een vloeistof of agas?
Welke factoren hebben de meeste invloed op de diffusiesnelheid in een vloeistof of agas?  Bij het uitvoeren van een chemische reactie die gas produceert, moet u de?
Bij het uitvoeren van een chemische reactie die gas produceert, moet u de?  Is zilvernitraat en zout water een fysische of chemische verandering?
Is zilvernitraat en zout water een fysische of chemische verandering?  Onderzoek onthult een nieuw mechanisme om te verklaren hoe continenten zich stabiliseerden
Onderzoek onthult een nieuw mechanisme om te verklaren hoe continenten zich stabiliseerden  Waarom wordt molconcept gebruikt bij het balanceren van de chemische vergelijking?
Waarom wordt molconcept gebruikt bij het balanceren van de chemische vergelijking?
 Historische gegevens helpen bij het ontdekken van een nieuw mechanisme in de dodelijke aardbeving in Taiwan in 1906
Historische gegevens helpen bij het ontdekken van een nieuw mechanisme in de dodelijke aardbeving in Taiwan in 1906 Insecten eten is goed voor jou en de planeet, onderzoekers staan erop:
Insecten eten is goed voor jou en de planeet, onderzoekers staan erop: Interessante feiten over stranden
Interessante feiten over stranden  Leiders roepen op tot dringende actie op het gebied van milieu
Leiders roepen op tot dringende actie op het gebied van milieu Wat zijn de landvormen van het gematigde loofbos?
Wat zijn de landvormen van het gematigde loofbos?
Hoofdlijnen
- Waarom katten meer levens hebben dan honden als het om slangenbeten gaat
- Wanneer water door een celmembraan beweegt, heet dit?
- Hoe kunnen er pitloze druiven zijn? Hoe kunnen ze zich voortplanten?
- Welke organel wordt de krachtpatser van Cell genoemd en speelt een rol in generatie -energie?
- Sterfgevallen onder dinosauriërs uitbesteed aan India?
- Hoeveel chromosomen zitten er in een Gibbon -spermacel?
- Welke botten zijn staaf gevormd in het lichaam?
- Wat is dochter kernen?
- Wat doet monocultuur in gewassen met de bodem?
- Ingenieurs bevorderen inzichten over zwarte fosfor als materiaal voor toekomstige flexibele elektronica met ultralaag vermogen
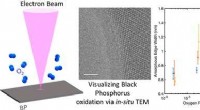
- Mechanisme van Cl-geïnitieerde oxidatie van methacroleïne onder NOx-vrije omstandigheden

- Microbiële diefstal maakt afbraak van methaan mogelijk, giftige methylkwik
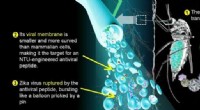
- Peptide maakt misbruik van achilleshiel van Zika-virus
- Hoe komt zuurstof in een brandstofcel?

 Waarom ziet Mars er op sommige momenten van het jaar helderder uit dan andere?
Waarom ziet Mars er op sommige momenten van het jaar helderder uit dan andere?  Welke soorten rots maakt een vulkaan?
Welke soorten rots maakt een vulkaan?  Mysterie over hoe slangen hun poten verloren, opgelost door reptielfossielen
Mysterie over hoe slangen hun poten verloren, opgelost door reptielfossielen  Welk orgaan bestaat uit gemodificeerde postganglionische neuronen zonder dendrities of axonen?
Welk orgaan bestaat uit gemodificeerde postganglionische neuronen zonder dendrities of axonen?  Hoe het gemiddelde van groepsgegevens te benaderen
Hoe het gemiddelde van groepsgegevens te benaderen  Glitter helpt oceaangolven te volgen
Glitter helpt oceaangolven te volgen Waarom geloven astronomen in donkere materie?
Waarom geloven astronomen in donkere materie? Pauze in de opwarming van de aarde was nooit echt, nieuw onderzoek bewijst
Pauze in de opwarming van de aarde was nooit echt, nieuw onderzoek bewijst
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

