
Wetenschap
Hoe werk je en empirische formule voor mandelzuur?
1. Begrijp empirische formules
* Een empirische formule toont de eenvoudigste verhouding van het hele nummer van atomen in een verbinding. Het vertelt u niet het exacte aantal atomen in een molecuul.
2. Informatie die u nodig heeft
* Percentage Samenstelling: U hebt de percentages nodig per massa van elk element in mandelzuur. Dit wordt meestal in het probleem gegeven.
* Atomische massa's: U hebt de atomaire massa's van elk element uit het periodiek systeem nodig.
3. Voorbeeld (laten we het volgende percentage samenstelling voor mandelzuur aannemen):
* Koolstof (C):63,15%
* Waterstof (H):5,30%
* Zuurstof (O):31,55%
4. Berekeningen
* Ga uit van 100 g mandelzuur: Dit maakt de percentages direct gelijk aan gram.
* Converteer grams in mollen: Verdeel de massa van elk element door zijn atoommassa:
* Koolstof:63.15 g / 12.01 g / mol =5,26 mol C
* Waterstof:5,30 g / 1.01 g / mol =5,25 mol H
* Zuurstof:31,55 g / 16,00 g / mol =1,97 mol O
* Zoek de eenvoudigste verhouding: Verdeel elke molwaarde door de kleinste molwaarde:
* Koolstof:5,26 mol / 1,97 mol =2,67 ≈ 2.7
* Waterstof:5,25 mol / 1,97 mol =2,67 ≈ 2.7
* Zuurstof:1,97 mol / 1.97 mol =1
* aanpassen aan hele getallen: Omdat we bijna 2,7 hebben, kunnen we alle waarden met 3 vermenigvuldigen om hele getallen te krijgen.
* Koolstof:2,7 x 3 =8
* Waterstof:2,7 x 3 =8
* Zuurstof:1 x 3 =3
5. Empirische formule
De empirische formule voor mandelzuur is c₈h₈o₃ .
Opmerking: Dit is alleen de empirische formule. De werkelijke moleculaire formule voor mandelzuur is C₈h₈o₃, die toevallig hetzelfde is als de empirische formule.
 Het vertragen van de rijping van druiven kan de kwaliteit van de bessen voor het maken van wijn verbeteren
Het vertragen van de rijping van druiven kan de kwaliteit van de bessen voor het maken van wijn verbeteren Welk type verbinding is negatief samengesteld of positief opgeladen?
Welk type verbinding is negatief samengesteld of positief opgeladen?  Wat wordt er van melet gemaakt?
Wat wordt er van melet gemaakt?  Wat is het nut van thermochrome pigmenten?
Wat is het nut van thermochrome pigmenten?  Waarom een onderzoeksproject van fruitbatterijen maken?
Waarom een onderzoeksproject van fruitbatterijen maken?
 Hittegolven en bosbranden om luchtvervuiling te verergeren:UN
Hittegolven en bosbranden om luchtvervuiling te verergeren:UN Fabrieken in Bangladesh moeten sluiten om belangrijke rivier te redden
Fabrieken in Bangladesh moeten sluiten om belangrijke rivier te redden Duizenden geëvacueerd in India nu sterke cycloon steeds dichterbij komt
Duizenden geëvacueerd in India nu sterke cycloon steeds dichterbij komt Hoe het Eden-project werkt
Hoe het Eden-project werkt  Bomcyclonen - de intense winterstormen die de VS (en ook Australië) troffen
Bomcyclonen - de intense winterstormen die de VS (en ook Australië) troffen
Hoofdlijnen
- Welke religie is Gregor Mendel?
- Hoe kan een puntmutatie de eiwitsynthese doen stoppen?
- Welke structuur verwijst naar de draaiende spiraalvormige vorm gevormd door sequentie en eigenschappen van aminozuren?
- Schaatsenrijders illustreren evolutionaire processen
- Wat zijn overblijfselen van structuren die belangrijke functies dienden in de voorouders van de organismen is het homoloog analoog overblijfselen of geen van beide?
- Wat is intracellulaire bron van spijsverteringsenzymen?
- Adipose en tefilmweefsels zijn voorbeelden van?
- Simulaties laten zien hoe gentherapie effectiever kan worden gemaakt
- Waar zijn cellen omringd door?
- Metaalschuim kan geluid onder hoge druk absorberen, omgevingen met hoge temperaturen zoals straalmotoren
- Nieuwe methode om antibioticaresistentie bij microben te bestrijden

- Vingerafdrukken missen wetenschappelijke basis voor rechtszekerheid

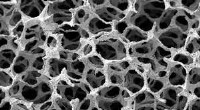
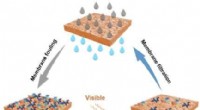
- Wetenschappers ontwikkelen N-gedoteerde zelfreinigende membranen die gebruik maken van bestraling met zichtbaar licht
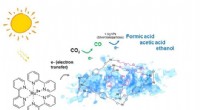
- Nieuwe door licht geactiveerde katalysator grijpt CO2 om ingrediënten voor brandstof te maken
 Veranderingen in de controle van het ijsvolume methaanemissies op de zeebodem
Veranderingen in de controle van het ijsvolume methaanemissies op de zeebodem Indringende vraag:Wat gebeurde er vóór de oerknal?
Indringende vraag:Wat gebeurde er vóór de oerknal?  Nieuwe inzichten in kwantummetingen
Nieuwe inzichten in kwantummetingen Hoe heet het object dat thermische energie en elektriciteit geleidt?
Hoe heet het object dat thermische energie en elektriciteit geleidt?  Klimaatprojecties laten minder kansen zien voor voorgeschreven branden
Klimaatprojecties laten minder kansen zien voor voorgeschreven branden  Zijn er elke nacht sterren aan de hemel?
Zijn er elke nacht sterren aan de hemel?  Hoe kun je Cosmic in een zin gebruiken?
Hoe kun je Cosmic in een zin gebruiken?  Stijgende zeespiegels zullen in sommige gebieden tot matige overstromingen leiden, ernstige overstromingen in anderen
Stijgende zeespiegels zullen in sommige gebieden tot matige overstromingen leiden, ernstige overstromingen in anderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

