
Wetenschap
Wat is de enthalpie van reactie-?
Reaction van reactie:
De enthalpie van reactie , ook bekend als de verandering in enthalpie , is de hoeveelheid warmte die wordt geabsorbeerd of afgegeven tijdens een chemische reactie die bij constante druk wordt uitgevoerd. Het is een fundamenteel concept in de thermodynamica en wordt weergegeven door het symbool ΔH .
Hier is een uitsplitsing:
* warmte: Een vorm van energie die wordt overgedragen tussen objecten of systemen vanwege een temperatuurverschil.
* absorptie: Wanneer een reactie * * warmte absorbeert, is dit endotherm en ΔH is positief.
* Release: Wanneer een reactie * vrijgeeft * warmte, is het exotherme en ΔH is negatief.
Hoe het is berekend:
* ΔH =H producten - H reactanten
* H producten is de enthalpie van de producten.
* H reactanten is de enthalpie van de reactanten.
belangrijke punten:
* Enthalpy of Reaction is een statusfunctie , wat betekent dat het alleen afhangt van de initiële en uiteindelijke toestanden van het systeem, niet op het genomen pad.
* Het wordt meestal uitgedrukt in kj/mol (kilojoules per mol).
* Standaard enthalpie van reactie (ΔH °) Verwijst naar de verandering in enthalpie wanneer de reactie optreedt onder standaardomstandigheden (druk van 298 K en 1 atm).
Toepassingen:
* Voorspelling of een reactie exotherme of endotherm zal zijn.
* Het berekenen van de hoeveelheid warmte die wordt geabsorbeerd of vrijgegeven in een reactie.
* Inzicht in de energieveranderingen geassocieerd met chemische processen.
Voorbeelden:
* verbranding: Brandende brandstoffen geven warmte vrij, dus de verbrandingsthalpie is negatief (exotherme).
* fotosynthese: Planten absorberen zonlicht om koolstofdioxide en water om te zetten in glucose, waardoor de enthalpie van fotosynthese positief (endotherm) wordt.
Samenvattend vertelt de reactie van de reactie ons hoeveel warmte betrokken is bij een chemische reactie en of de reactie energie vrijgeeft of absorbeert. Het is een cruciaal concept om de energiebalans van chemische processen te begrijpen.
 Een gepatenteerde oplossing voor het verlichten van droge mond en de ontwikkeling van voedingsproducten
Een gepatenteerde oplossing voor het verlichten van droge mond en de ontwikkeling van voedingsproducten Elektronenstraal versterkt recyclebaar nanocomposiet
Elektronenstraal versterkt recyclebaar nanocomposiet Hoe wordt koolstof gebruikt om metaal uit ertsen te winnen?
Hoe wordt koolstof gebruikt om metaal uit ertsen te winnen?  Heeft deze chemische reactie de bouwstenen van het leven op aarde gecreëerd?
Heeft deze chemische reactie de bouwstenen van het leven op aarde gecreëerd?  Hoe kan stikstof worden gebruikt?
Hoe kan stikstof worden gebruikt?
 Wat is het verschil tussen een das en een Wolverine?
Wat is het verschil tussen een das en een Wolverine?  Studie toont Witte Huis, Pentagon zijn letterlijk enkele van de populairste plekken in Washington
Studie toont Witte Huis, Pentagon zijn letterlijk enkele van de populairste plekken in Washington Diepgewortelde minerale aderen zijn microbiële begraafplaatsen
Diepgewortelde minerale aderen zijn microbiële begraafplaatsen Wat eet koraalriffen?
Wat eet koraalriffen?  Onderzoekers lossen het vormingsmechanisme van sferische carbonaatconcreties op
Onderzoekers lossen het vormingsmechanisme van sferische carbonaatconcreties op
Hoofdlijnen
- Onderzoek toont aan dat regenererende wormen genetische controle hebben over hun algenpartners
- Welke functies dienen displays en rituelen op dieren?
- Studie onderzoekt waarom sommige STEM-gebieden minder vrouwen hebben dan andere
- Wat is het verschil tussen de biologische term fitness en de algemene betekenis van het woord?
- Wat zijn interacterende populaties?
- Waarom jagen vrouwelijke pinguïns eerst op eten?
- Wie heeft Regelion uitgevonden?
- Welke technologie werd mogelijk gemaakt door de ontdekking van structuur -DNA?
- Hoe een ontevreden wetenschapper wilde bewijzen dat zijn voedsel niet nieuw ontdekte radioactieve tracers was en de Nobelprijs won
- Inzicht in katalyse door nieuwe studie van röntgenabsorptiespectroscopie

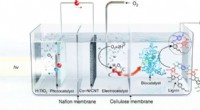
- Nieuw biokatalytisch systeem zet afvalbiomassa om in chemicaliën met toegevoegde waarde
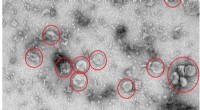
- Onderzoekers ontdekken een nieuw mechanisme dat de polariteit van vlakke cellen reguleert
- Neutronen onthullen de wilde Weyl-wereld van halfmetalen

- Spiropyran-gefunctionaliseerde fotochrome nylon banden voor langdurige detectie van ultraviolet licht

 Turing-test voor androïden zal beoordelen hoe levensecht humanoïde robots kunnen zijn
Turing-test voor androïden zal beoordelen hoe levensecht humanoïde robots kunnen zijn De beste landbouwpraktijken voor bodemgezondheid verschillen per regio
De beste landbouwpraktijken voor bodemgezondheid verschillen per regio Wat is de evenwichtige vergelijking wanneer zink reageert met zwavelzuur?
Wat is de evenwichtige vergelijking wanneer zink reageert met zwavelzuur?  Wat is het vermogen om te ontbinden?
Wat is het vermogen om te ontbinden?  Waarom worden korstmossen gemakkelijk aangetast door vervuiling?
Waarom worden korstmossen gemakkelijk aangetast door vervuiling?  Ball Drop Science Projects
Ball Drop Science Projects  Het raadsel van de hemelse barsten
Het raadsel van de hemelse barsten Facebook:waren beter in het controleren van naaktheid dan in het aanzetten tot haat
Facebook:waren beter in het controleren van naaktheid dan in het aanzetten tot haat
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

