
Wetenschap
Wat zegt de wet over de enthalpie van een reactie?
Dit is wat het zegt:
Hess's Law: De enthalpieverandering van een reactie is onafhankelijk van het genomen pad. Dit betekent dat de totale enthalpiewijziging voor een reactie hetzelfde is, of deze in één stap of een reeks stappen voorkomt.
Hier is hoe het van toepassing is op enthalpie:
* Enthalpy Change (ΔH): De wet van Hess vertelt ons dat de algehele enthalpiewijziging voor een reactie de som is van de enthalpiewijzigingen voor elke individuele stap in de reactie.
* Standaard enthalpie van formatie (ΔHF °): Dit is de enthalpie -verandering wanneer een mol van een verbinding wordt gevormd uit zijn elementen in hun standaardstaten. De wet van Hess stelt ons in staat om de standaardvormingsenthalpie voor een verbinding te berekenen met behulp van bekende standaard enthalpie van formatiewaarden voor andere verbindingen die bij de reactie betrokken zijn.
* Berekening van enthalpiewijzigingen: De wet van Hess is een krachtig hulpmiddel voor het berekenen van enthalpiewijzigingen voor reacties die moeilijk of onmogelijk te meten zijn. We kunnen een complexe reactie in eenvoudigere stappen afbreken met bekende enthalpiewijzigingen en vervolgens de wet van Hess gebruiken om de algehele enthalpiewijziging te berekenen.
Voorbeeld:
Stel je voor dat je de enthalpie -verandering wilt vinden voor de verbranding van methaan (CH4). Je zou het direct in een calorimeter kunnen meten, maar je kunt het ook berekenen met behulp van de wet van Hess:
1. Stap 1: CH4 (G) + 2O2 (G) → CO2 (G) + 2H2O (L)
* Dit is de algehele reactie.
2. Stap 2: C (s) + o2 (g) → CO2 (g)
* Dit is de verbranding van koolstof, met een bekende AH.
3. Stap 3: 2H2 (G) + O2 (G) → 2H2O (L)
* Dit is de verbranding van waterstof, met een bekende AH.
Met behulp van de wet van Hess kunt u de enthalpiewijzigingen combineren van stappen 2 en 3 om de enthalpiewijziging voor stap 1 (de verbranding van methaan) te berekenen.
Samenvattend is de wet van Hess een fundamentele wet in de thermodynamica waarmee we de enthalpieveranderingen kunnen begrijpen en berekenen die verband houden met chemische reacties.
 Cofactor-engineering stimuleert de synthese van natuurlijke producten
Cofactor-engineering stimuleert de synthese van natuurlijke producten Waarom wordt chloor gebruikt voor waterbehandeling?
Waarom wordt chloor gebruikt voor waterbehandeling?  Wanneer bij Atom wordt opgeladen, wordt het een ion genoemd, hoeveel elektronen zijn er in O2-?
Wanneer bij Atom wordt opgeladen, wordt het een ion genoemd, hoeveel elektronen zijn er in O2-?  De kracht van honing door zijn eiwitten begrijpen
De kracht van honing door zijn eiwitten begrijpen Heeft water een meetbare pH-waarde?
Heeft water een meetbare pH-waarde?
 Veranderingen in niet-extreme neerslag kunnen minder subtiele gevolgen hebben
Veranderingen in niet-extreme neerslag kunnen minder subtiele gevolgen hebben Geruisloze rivierbubbeltaxi vaart door test in Parijs
Geruisloze rivierbubbeltaxi vaart door test in Parijs Microplastics zijn overal, studie vondsten
Microplastics zijn overal, studie vondsten Plasticvervuiling verhoogt de druk op de onrustige schildpadden in Myanmar
Plasticvervuiling verhoogt de druk op de onrustige schildpadden in Myanmar Nieuwe studie onthult dat de Verenigde Staten een belangrijke bron van plasticvervuiling zijn in kustgebieden
Nieuwe studie onthult dat de Verenigde Staten een belangrijke bron van plasticvervuiling zijn in kustgebieden
Hoofdlijnen
- Hoe u het hart van uw hond gezond kunt houden
- Wat is 11Degease Celleneas in Fahrenheit?
- Wat is een organel in een cel?
- Hoe onderzoekers synthetische chromosomen sneller en goedkoper 'CREËREN'
- Als alle sekscellen een organisme een allel genotype hebben dat moet zijn?
- Mariene microbiële populaties:potentiële sensoren van de mondiale verandering in de oceaan
- De willekeurige verdeling van homologe chromosomen tijdens meiose wordt genoemd?
- Een geslacht van Europese papierwespen voor het eerst herzien met behulp van integratieve taxonomie
- Wat bepaalt welke eigenschappen het meest frequent aan de volgende generatie worden doorgegeven?
- Aantrekkingskracht creëren tussen moleculen diep in het periodiek systeem

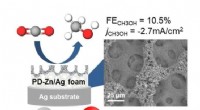
- Omzetting van kooldioxide naar methanol
- Hoe een biofysische simulatiemethode het ontdekken van medicijndoelen kan versnellen?
- Nieuwe methode om mineralen te analyseren onder terrestrische en Martiaanse atmosferische omstandigheden

- Antibioticaresistentie verlichten:onderzoekers zetten stappen in de richting van een nieuwe behandeling voor E. coli

 Actieve schietoefeningen kunnen de manier waarop een generatie studenten naar school kijkt veranderen
Actieve schietoefeningen kunnen de manier waarop een generatie studenten naar school kijkt veranderen Hogetemperatuursensortechnologieën om de efficiëntie van de energiecentrale te verhogen
Hogetemperatuursensortechnologieën om de efficiëntie van de energiecentrale te verhogen Welke objecten bevatten gas?
Welke objecten bevatten gas?  Graan meten in ronde bakken
Graan meten in ronde bakken  Wil je minder pandemische stress? Overweeg om je te laten vaccineren
Wil je minder pandemische stress? Overweeg om je te laten vaccineren Hoeveel in 250 ml gelijk aan vloeibare ounces?
Hoeveel in 250 ml gelijk aan vloeibare ounces?  Een voorbeeld van een biologische katalysator?
Een voorbeeld van een biologische katalysator?  Welk gemeenschappelijk element hebben alle hedendaagse benaderingen die bestudeerd worden?
Welk gemeenschappelijk element hebben alle hedendaagse benaderingen die bestudeerd worden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

