
Wetenschap
Bij constante druk hoe varieert het volume van 1 mol een ideaal gas?
v₁/t₁ =v₂/t₂
Waar:
* v₁ is het eerste volume
* t₁ is de begintemperatuur (in Kelvin)
* v₂ is het laatste deel
* t₂ is de laatste temperatuur (in Kelvin)
Verklaring:
* Naarmate de temperatuur van een ideaal gas toeneemt, neemt de gemiddelde kinetische energie van de gasmoleculen toe.
* Deze verhoogde kinetische energie zorgt ervoor dat de moleculen sneller bewegen en vaker met de wanden van de container botsen en met een grotere kracht.
* Om de constante druk te behouden, moet het volume van de container toenemen om de grotere kracht van de botsingen tegemoet te komen.
Daarom, als u bij constante druk de temperatuur van 1 mol van een ideaal gas verhoogt, zal het volume evenredig toenemen.
 Hoe drinkwater chloorvrij te leveren
Hoe drinkwater chloorvrij te leveren  Wat is het product van waterige oplossingen waarbij fosforzuur en natriumhydroxide met elkaar worden gemengd?
Wat is het product van waterige oplossingen waarbij fosforzuur en natriumhydroxide met elkaar worden gemengd?  SLAC's hogesnelheidselektronencamera filmt moleculaire film in HD
SLAC's hogesnelheidselektronencamera filmt moleculaire film in HD Hoe gistademhaling te meten
Hoe gistademhaling te meten Hoe is het verbranden van een marshmellow chemische verandering?
Hoe is het verbranden van een marshmellow chemische verandering?
 Te gek? Water verplaatsen van overstroming naar droogte
Te gek? Water verplaatsen van overstroming naar droogte  NASA ziet grote regenval na tropische cycloon Nates
NASA ziet grote regenval na tropische cycloon Nates Welke invloed kunnen lawines op mensen hebben?
Welke invloed kunnen lawines op mensen hebben?  Hoe u een 14-daagse weersvoorspelling online krijgt
Hoe u een 14-daagse weersvoorspelling online krijgt Leren hoe kleding wordt gemaakt heeft een 'transformatief' effect op de relatie van mensen met fast fashion
Leren hoe kleding wordt gemaakt heeft een 'transformatief' effect op de relatie van mensen met fast fashion
Hoofdlijnen
- Hoe wordt een enzym gedenatureerd?
- Wat zijn de vier macromoleculen van het leven?
- Onderzoekers ontdekken hoe cellen bewegen terwijl ze adhesie vermijden
- Welk doel dienen verminderde mitochondriën?
- Wat is Jamais Vu?
- Wetenschappers boeken vooruitgang bij het bepalen hoe de hersenen geluid selectief interpreteren
- Wat wordt bedoeld met een dochtercel?
- Bio-informatici schrappen een onnodige stap in eiwitstabiliteitsanalyse
- Wat betekent Evolve?
- Echte truffels opsnuiven
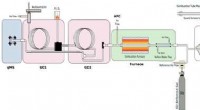
- In legeringen met vormgeheugen, de juiste combinatie van kristalkorrels kan een hoge sterkte bereiken en toch geheugen behouden
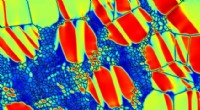
- Een hydrogel die stevig hecht aan kraakbeen en meniscus

- Nieuwe slimme materialen om wereldwijde uitdagingen aan te gaan

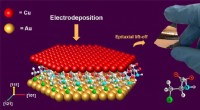
- Onderzoekers gebruiken aminozuren om hoogwaardige dunne koperfilms te laten groeien
 Nieuwe techniek integreert koolstof-14 in één stap voor een veiligere, efficiëntere ontdekking van geneesmiddelen
Nieuwe techniek integreert koolstof-14 in één stap voor een veiligere, efficiëntere ontdekking van geneesmiddelen  Wetenschappers vinden persistente organische verontreinigende stoffen in dierenbont
Wetenschappers vinden persistente organische verontreinigende stoffen in dierenbont Psycholoog bespreekt hoe #metoo solidariteit creëert voor slachtoffers van seksuele intimidatie
Psycholoog bespreekt hoe #metoo solidariteit creëert voor slachtoffers van seksuele intimidatie  Wat is ionisatie-energie?
Wat is ionisatie-energie?  Voordelen van een PCB Board
Voordelen van een PCB Board Van speeltuin tot directiekamers:hoe kindertijd en adolescentie toekomstige leiders vormen
Van speeltuin tot directiekamers:hoe kindertijd en adolescentie toekomstige leiders vormen  Onderzoekers vinden de slechtste reden om een cadeau te geven
Onderzoekers vinden de slechtste reden om een cadeau te geven Zijn gashydraten een bron van milieuvriendelijke energie?
Zijn gashydraten een bron van milieuvriendelijke energie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

