
Wetenschap
Worden elektronen gelijk gedeeld in CH4?
Dit is waarom:
* elektronegativiteit: Koolstof (C) heeft een hogere elektronegativiteit dan waterstof (H). Dit betekent dat koolstof elektronen sterker aantrekt dan waterstof.
* Polaire covalente bindingen: De C-H-bindingen in methaan worden beschouwd als polaire covalente bindingen. Hoewel de elektronen worden gedeeld, worden ze niet gelijk gedeeld. Het koolstofatoom trekt de gedeelde elektronen iets dichter bij zichzelf, waardoor een enigszins negatieve lading op het koolstofatoom en een enigszins positieve lading op de waterstofatomen ontstaat.
Het is echter belangrijk op te merken dat methaan nog steeds wordt beschouwd als een nonpolair molecuul algemeen. Dit komt omdat de vier C-H-obligaties symmetrisch rond het koolstofatoom zijn gerangschikt, waardoor de lichte polariteit elkaar annuleert.
 Welke grootheid is onafhankelijk van het afgelegde pad?
Welke grootheid is onafhankelijk van het afgelegde pad?  Wat is de formule voor tetrachloorkoolstof en is het ionisch of covalent?
Wat is de formule voor tetrachloorkoolstof en is het ionisch of covalent?  Wat zijn voorbeelden van elementen met één als hun valentie, dat wil zeggen monovalente elementen geven?
Wat zijn voorbeelden van elementen met één als hun valentie, dat wil zeggen monovalente elementen geven?  Welke atomen zijn in kalium?
Welke atomen zijn in kalium?  Waarom is het belangrijk om de chemie van verschillende dingen te begrijpen bij het bestuderen van milieuwetenschap?
Waarom is het belangrijk om de chemie van verschillende dingen te begrijpen bij het bestuderen van milieuwetenschap?
 Hoop voor salamanders? Studie herkalibreert de effecten van klimaatverandering
Hoop voor salamanders? Studie herkalibreert de effecten van klimaatverandering  NASA's IMERG meet zware regenval in natuurbrandgebieden in Californië
NASA's IMERG meet zware regenval in natuurbrandgebieden in Californië Vijf dingen om te weten over plastic afval en recycling in India
Vijf dingen om te weten over plastic afval en recycling in India Biokolonisatorsoorten brengen het behoud van het graniet in Machu Picchu in gevaar
Biokolonisatorsoorten brengen het behoud van het graniet in Machu Picchu in gevaar Het energiebeleid van China moet de luchtkwaliteit in evenwicht brengen, doelstellingen voor koolstofemissies en waterschaarste
Het energiebeleid van China moet de luchtkwaliteit in evenwicht brengen, doelstellingen voor koolstofemissies en waterschaarste
Hoofdlijnen
- Verrassend onderzoek bij apen vindt dat slechte tijden er niet toe leiden dat groepsleden hun gedrag veranderen
- Wat is een kernenvelopmembraan?
- Hoe zijn de vossenpopulaties in West-Europa in de loop van de tijd veranderd?
- Uit welke elementen bestaat glucose?
- Waarom gooit mijn kat overal kattenbakvulling? Vier tips van kattenexperts
- Genetisch gemodificeerd voedsel, wie moet het vertellen?
- Is het evolutieproces waarmee de persoon die het beste zijn aangepast, overleven en zich voortplanten?
- Wanneer begint de genderkloof op het gebied van de informatica?
- Hoe divers is uw sociale netwerk? Het antwoord kan iets over waarden onthullen
- Er kunnen meer monden worden gevoed door het aantal plantporiën te vergroten
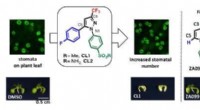
- Voeg gewoon nanomaterialen toe voor sterkere, hardere duikvinnen

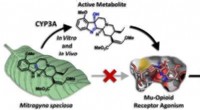
- Kratoms befaamde pijnstillende voordelen kunnen afkomstig zijn van een van zijn metabolieten
- Een radicale oplossing komt van het mengen van gereedschappen

- Nieuwe biobrandstoftechnologie verkort de productietijd aanzienlijk

 Hoe licht water kan verdampen zonder dat er warmte nodig is
Hoe licht water kan verdampen zonder dat er warmte nodig is  Britse huishoudens steunen een terugkeer naar waterstof als huisbrandstof
Britse huishoudens steunen een terugkeer naar waterstof als huisbrandstof Hoe bacteriën zwemmen:onderzoekers ontdekken nieuwe mechanismen
Hoe bacteriën zwemmen:onderzoekers ontdekken nieuwe mechanismen  Een schimmel zet cellulose direct om in een nieuwe platformchemische stof
Een schimmel zet cellulose direct om in een nieuwe platformchemische stof  Kwantuminterferentie waargenomen in realtime:Extreme UV-lichtspectroscopietechniek
Kwantuminterferentie waargenomen in realtime:Extreme UV-lichtspectroscopietechniek Prijs van gegalvaniseerd staal versus Roestvrij staal
Prijs van gegalvaniseerd staal versus Roestvrij staal Hoe een instrument te maken voor een schoolproject
Hoe een instrument te maken voor een schoolproject  Wat is CO2-gas?
Wat is CO2-gas?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

