
Wetenschap
Hoe teken je een atoommodel voor het element cu?
1. Bepaal de belangrijkste informatie:
* Atomisch nummer: Koper heeft een atoomnummer van 29, wat betekent dat het 29 protonen heeft.
* Atomische massa: De atoommassa van koper is ongeveer 63,55 AMU (atomaire massa -eenheden). Dit vertelt ons dat het ongeveer 34 neutronen heeft (63,55 - 29 =34,55, die we afsluiten omdat neutronen en protonen ongeveer dezelfde massa hebben).
* Elektronenconfiguratie: De elektronenconfiguratie voor koper is 1S²2S²2P⁶3S²3P⁶4S¹3d¹⁰. Dit is enigszins ongebruikelijk vanwege de gevulde 3D -subshell, die koper grotere stabiliteit geeft.
2. De kern trekken:
* protonen en neutronen: Teken een cirkel in het midden om de kern weer te geven. Schrijf in de cirkel "29p+" (29 protonen) en "34n" (34 neutronen). U kunt verschillende kleuren gebruiken om protonen en neutronen weer te geven als u wilt.
3. De elektronen vertegenwoordigen:
* energieniveaus: Teken concentrische cirkels rond de kern om de elektronenschalen (energieniveaus) weer te geven. Deze schalen komen overeen met de belangrijkste kwantumnummers (n):
* shell 1 (n =1): Teken de eerste cirkel die het dichtst bij de kern ligt. Het bevat 2 elektronen (1S²).
* shell 2 (n =2): Teken de tweede cirkel. Het bevat 8 elektronen (2S²2P⁶).
* shell 3 (n =3): Teken de derde cirkel. Het bevat 18 elektronen (3S²3P⁶4S¹3d¹⁰).
* Subshells: U kunt ook kleine cirkels binnen elk energieniveau gebruiken om de subshells (S, P, D, F) weer te geven. Dit kan echter lastig zijn, omdat de 3D -subshell vult voor de 4s.
* Elektronenplaatsing: Plaats de elektronen als stippen of kleine kruisen binnen hun respectieve schelpen/subshells, waarbij u zich het maximale aantal elektronen kan herinneren dat elk kan vasthouden.
4. Labels en uiteindelijke details:
* labeling: Schrijf "Cu" (het elementsymbool) boven de kern.
* Aanvullende informatie: U kunt ook het atoomnummer en de atomaire massa opnemen, maar het is niet strikt noodzakelijk.
vereenvoudigd atoommodel:
Voor een eenvoudigere weergave kunt u de kern gewoon tekenen met het aantal protonen en neutronen, vervolgens cirkels tekenen die de energieniveaus vertegenwoordigen en de elektronen in die cirkels plaatsen.
Onthoud: Dit is een vereenvoudigd model. Atomische modellen evolueren voortdurend om de complexe aard van atomen beter weer te geven.
 Bipolaire volgorde:een eenvoudige techniek om meer controle te hebben over organische dunne films
Bipolaire volgorde:een eenvoudige techniek om meer controle te hebben over organische dunne films Wat zijn de toepassingen van chemie in de landbouw?
Wat zijn de toepassingen van chemie in de landbouw?  Welke merken antivries zijn fosfaatvrij?
Welke merken antivries zijn fosfaatvrij?  Is ductiel en kneedbaar een chemische eigenschap of een fysische eigenschap?
Is ductiel en kneedbaar een chemische eigenschap of een fysische eigenschap?  Travelling-wave ion mobility massaspectrometrie verheldert structuren van gouden vingers
Travelling-wave ion mobility massaspectrometrie verheldert structuren van gouden vingers
 Aanvulling van grondwater nauwkeuriger berekenen
Aanvulling van grondwater nauwkeuriger berekenen Studie:Milieurisico's verergerd voor kwetsbare bevolkingsgroepen in kleine steden
Studie:Milieurisico's verergerd voor kwetsbare bevolkingsgroepen in kleine steden Kenmerken van het land in het Biome-zoetwaterbiotoestel
Kenmerken van het land in het Biome-zoetwaterbiotoestel  Ophoping van plastic in voedsel kan worden onderschat
Ophoping van plastic in voedsel kan worden onderschat Cristobal verzwakt tot tropische depressie als zware regenval Amerikaanse staten treft (update)
Cristobal verzwakt tot tropische depressie als zware regenval Amerikaanse staten treft (update)
Hoofdlijnen
- Zijn de Milkweed Plant en Monarch Caterpillar van elkaar afhankelijk?
- Wat is de laatste gemeenschappelijke voorouder?
- Kopiëren of innoveren? Studie werpt licht op de chimpanseecultuur
- Trilaminaire structuur van het celmembraan
- Hoe evolutie werkt
- De biodiversiteit van de aarde verandert naarmate de planeet opwarmt. Maar hoe?
- Cellen bij elkaar houden:hoe ons lichaam mechanische stress weerstaat
- Hoe DNA-reparatie fout kan gaan en tot ziekte kan leiden
- Biologisch onderzoek suggereert dat voeding van vaders vóór seks kan bijdragen aan de gezondheid van de baby
- Experimentele observatie van de schaal van het elastische bereik in turbulente stroming met polymeeradditieven
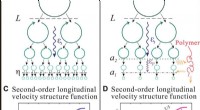
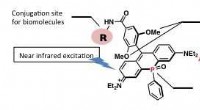
- Een nabij-infrarood fluorescerende kleurstof voor bio-imaging op lange termijn
- Onderzoekers ontwikkelen 3D-geprinte biomaterialen die op verzoek worden afgebroken

- Bepaling van de parameters voor transmissie-elektronenmicroscopie
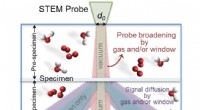
- Nieuwe methode maakt de weg vrij voor snijgereedschappen met een langere levensduur

 Waar komen de kosmische straling met de hoogste energie vandaan? Niet door gammaflitsen, zegt IceCube-onderzoek
Waar komen de kosmische straling met de hoogste energie vandaan? Niet door gammaflitsen, zegt IceCube-onderzoek  Simulaties laten zien dat politiek gemotiveerde gerrymandering zich meestal op nationale schaal uitbreidt
Simulaties laten zien dat politiek gemotiveerde gerrymandering zich meestal op nationale schaal uitbreidt  Lagetemperatuurfysica geeft inzicht in turbulentie
Lagetemperatuurfysica geeft inzicht in turbulentie Welk ecosysteem komt voor op 30 graden noord- en zuiden?
Welk ecosysteem komt voor op 30 graden noord- en zuiden?  Het is geen gebrek aan vertrouwen dat vrouwen in STEM tegenhoudt
Het is geen gebrek aan vertrouwen dat vrouwen in STEM tegenhoudt Welk type gamete wordt geproduceerd via oogenese?
Welk type gamete wordt geproduceerd via oogenese?  Kan een kopje zout en water beide een oplossing zijn?
Kan een kopje zout en water beide een oplossing zijn?  Is het waar of niet waar dat de overdracht van thermische energie door straling geen materie vereist?
Is het waar of niet waar dat de overdracht van thermische energie door straling geen materie vereist?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

