
Wetenschap
Waarom elektron vrij in een metaal?
1. Het model "zee van elektronen":
* Metalen hebben een unieke structuur waarbij de buitenste valentie -elektronen van elk atoom losjes gebonden zijn.
* Deze valentie -elektronen zijn niet geassocieerd met een specifiek atoom, maar worden eerder gedelocaliseerd en verspreid over het hele metalen rooster. Dit creëert een "zee" van mobiele elektronen.
2. Energiebanden:
* Elektronen in atomen bezetten specifieke energieniveaus, die worden gekwantiseerd.
* In metalen overlappen deze energieniveaus zich om "banden" van toegestane energieën te vormen. De valentieband (waar de buitenste elektronen zich bevinden) overlapt met de geleidingsband (waar elektronen vrij kunnen bewegen).
* Deze overlap betekent dat zelfs een kleine hoeveelheid energie een elektron van de valentieband naar de geleidingsband kan opwinden, waardoor het vrij kan bewegen.
3. Zwakke aantrekkingskracht op het rooster:
* De positieve ionen in het metalen rooster hebben een relatief zwakke aantrekkingskracht op de gedelokaliseerde elektronen.
* Hierdoor kunnen de elektronen gemakkelijk door het metaal bewegen, zelfs onder invloed van een elektrisch veld.
4. Mobiliteit en geleidbaarheid:
* Het vrije verkeer van elektronen is de reden waarom metalen uitstekende geleiders van elektriciteit en warmte zijn.
* Wanneer een elektrisch veld wordt aangebracht, stromen de elektronen in de richting van het veld, met lading en energie.
Belangrijke opmerking:
Hoewel elektronen in metalen zeer mobiel zijn, zijn ze niet helemaal gratis. Ze ervaren nog steeds enige interactie met de positieve ionen in het rooster, die hun beweging beïnvloeden.
Samenvattend leidt de combinatie van gedelokaliseerde elektronen, overlappende energiebanden en zwakke aantrekkingskracht op het rooster tot de karakteristieke hoge mobiliteit van elektronen in metalen, waardoor ze uitstekende geleiders zijn.
 Waarom denk je dat waterstof in het verleden werd gebruikt om Zeppelins blimps luchtlucht te laten zweven?
Waarom denk je dat waterstof in het verleden werd gebruikt om Zeppelins blimps luchtlucht te laten zweven?  Goede effecten van chemische veranderingen in het milieu?
Goede effecten van chemische veranderingen in het milieu?  Met een grotere container kan een gas meer ruimte innemen?
Met een grotere container kan een gas meer ruimte innemen?  Ontdekking van poreuze vloeistof leidt tot nieuw spin-outbedrijf
Ontdekking van poreuze vloeistof leidt tot nieuw spin-outbedrijf Katalyseren van de omzetting van biomassa naar biobrandstof
Katalyseren van de omzetting van biomassa naar biobrandstof
 Wormen die in Sheetrock graven
Wormen die in Sheetrock graven  Sterk, maar diep, aardbeving schudt het noorden van de Filipijnen
Sterk, maar diep, aardbeving schudt het noorden van de Filipijnen Dringende noodzaak om vlees- en zuivelconsumptie te verminderen om klimaatdoelstellingen te halen, zegt expert
Dringende noodzaak om vlees- en zuivelconsumptie te verminderen om klimaatdoelstellingen te halen, zegt expert Orkaanwaarschuwingen terwijl de Amerikaanse Golfkust zich schrap zet voor Gordon
Orkaanwaarschuwingen terwijl de Amerikaanse Golfkust zich schrap zet voor Gordon Verzuring in de Noordelijke IJszee erger dan verwacht
Verzuring in de Noordelijke IJszee erger dan verwacht
Hoofdlijnen
- Onderzoek onthult belangrijke genetische factoren in de eigenschappen van bonenpeulen
- Ervaren dieren geluk?
- Hoe een zevende-graadsmodel van een dierencel te bouwen
- Verschillen van prokaryotische en eukariotische cellen?
- Hebben alle planten vaatbundels?
- Hoe de gecorrigeerde WBC-telling te berekenen
- Wat is een taak van sekscel?
- De verschillen in broederlijke en vaderlijke tweelingen
- Voorbeelden van stoffen die gefaciliteerde diffusie gebruiken
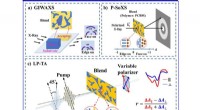
- Moleculaire oriëntatie onderzoeken door polarisatie-selectieve transiënte absorptiespectroscopie
- Dun, rekbare biosensoren kunnen chirurgie veiliger maken
- Groene waterstof:onderzoek om efficiëntie te verhogen

- Elementen kunnen tegelijkertijd vast en vloeibaar zijn, studie onthult

- Krachtige laserdiodes kunnen restspanning in 3D-geprinte metalen onderdelen verminderen

 Wat is mariene sneeuw?
Wat is mariene sneeuw?  Waarom kan zilvernitraatoplossing niet in een ijzeren glas worden bewaard?
Waarom kan zilvernitraatoplossing niet in een ijzeren glas worden bewaard?  Symptomen zitten allemaal in uw hoofd – of in uw onderbuik? Misschien een beetje van beide.
Symptomen zitten allemaal in uw hoofd – of in uw onderbuik? Misschien een beetje van beide.  Verticale snelheid berekenen
Verticale snelheid berekenen  Uit onderzoek blijkt hoe supergeleiding in supergeleiders aan en uit kan worden gezet
Uit onderzoek blijkt hoe supergeleiding in supergeleiders aan en uit kan worden gezet  Welke wetenschapper veroorzaakte controverse die vandaag nog steeds bestaat?
Welke wetenschapper veroorzaakte controverse die vandaag nog steeds bestaat?  Een keuze tussen thuis en werk – hoe genderongelijkheid op het werk ervoor zorgt dat vrouwen zelden alles kunnen hebben
Een keuze tussen thuis en werk – hoe genderongelijkheid op het werk ervoor zorgt dat vrouwen zelden alles kunnen hebben Biedt een tweede slag in de T20 wereldbeker cricket een cruciaal voordeel? Een hoogleraar statistiek legt het uit
Biedt een tweede slag in de T20 wereldbeker cricket een cruciaal voordeel? Een hoogleraar statistiek legt het uit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

