
Wetenschap
Wanneer 15,0 g en NACIO3 20.0 Cr2O3 reageren die de reactie beperken?
1. Evenwichtige chemische vergelijking:
We hebben de evenwichtige chemische vergelijking nodig om de stoichiometrische verhouding van reactanten te kennen. Helaas hebt u de volledige chemische vergelijking voor de reactie tussen NACLO3 en CR2O3 niet verstrekt.
2. Molaire massa's:
* NaClo3:106.44 g/mol
* CR2O3:151.99 g/mol
3. Berekening:
Laten we een hypothetische evenwichtige vergelijking voor illustratie aannemen (dit is misschien niet de werkelijke evenwichtige vergelijking):
2 NACLO3 + CR2O3 → Producten
Om de beperkende reactant te bepalen, berekenen we de mol van elke reactant:
* mol NaClo3: (15,0 g) / (106,44 g / mol) =0,141 mol
* mol Cr2O3: (20,0 g) / (151,99 g / mol) =0,132 mol
Nu zullen we de molverhoudingen van de reactanten vergelijken op basis van de evenwichtige vergelijking. De vergelijking suggereert een 2:1 molverhouding van NaClo3 tot Cr2O3.
* Uit de berekende mol: We hebben 0,141 mol NACLO3 en 0,132 mol Cr2O3.
* van de evenwichtige vergelijking: Voor elke 2 mol NaClo3 hebben we 1 mol Cr2O3 nodig.
Omdat we een iets hogere molverhouding van NaClo3 hebben dan wat de vergelijking vereist, is CR2O3 de beperkende reactant . Dit komt omdat we niet genoeg CR2O3 hebben om met alle NaClo3 te reageren.
Belangrijke opmerking: Deze verklaring is gebaseerd op een hypothetische evenwichtige vergelijking. Om de werkelijke beperkende reactant te bepalen, hebt u de juiste gebalanceerde chemische vergelijking nodig voor de reactie tussen NaClo3 en Cr2O3.
 Arizonas Grand Falls komt weer tot leven
Arizonas Grand Falls komt weer tot leven Wat gebeurt er als tegenstrijdige prioriteiten botsen en mogelijk bomen en bosbossen in gevaar brengen?
Wat gebeurt er als tegenstrijdige prioriteiten botsen en mogelijk bomen en bosbossen in gevaar brengen?  Grasdeskundigen leggen uit waarom het mulchen van bladeren een betere oplossing is dan weggooien
Grasdeskundigen leggen uit waarom het mulchen van bladeren een betere oplossing is dan weggooien  Waarom gewone mensen inspraak moeten hebben in waterbeheer
Waarom gewone mensen inspraak moeten hebben in waterbeheer Waarom kraken eekhoorns in bomen?
Waarom kraken eekhoorns in bomen?
Hoofdlijnen
- Wat is het verschil tussen prokaryotische en eukaryote cellen?
- De krimpende eland van Isle Royale
- Belangrijke plantensoorten kunnen belangrijk zijn voor het ondersteunen van bestuivers van wilde bloemen
- Codominantie: definitie, toelichting en voorbeeld
- Wat is het beste weefsel om DNA te extraheren?
- Zijn kurkcellen leeg of gevuld?
- Honden en zwerfdieren lijden onder de hittegolf in Azië
- Wat is de wetenschappelijke naam van lederen buffel?
- Het redden van Indonesische paradijsvogels dorp voor dorp
- Dit molecuul is gemaakt van suiker, in de vorm van een donut, en gevormd met behulp van licht
- Kunstmatige cellen reageren op veranderingen in de omgeving
- Onderzoekers remmen de groei van kankercellen met verbindingen die planten beschermen tegen roofdieren
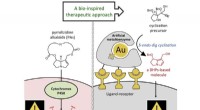
- Een polymere liefdeshormoonsensor voor de vroege detectie van autisme

- Een nieuwe manier om moleculen te maken voor de ontwikkeling van geneesmiddelen

 Kijk uit, baai, de e-scooterrevolutie komt naar een stoep bij jou in de buurt
Kijk uit, baai, de e-scooterrevolutie komt naar een stoep bij jou in de buurt Een oceaan van sterrenstelsels wacht:nieuwe COMAP-radio-enquête
Een oceaan van sterrenstelsels wacht:nieuwe COMAP-radio-enquête  Wat is de chemische samenstelling van creatine?
Wat is de chemische samenstelling van creatine?  Unboil een eiermachine zorgt voor een verbeterde bacteriedetector
Unboil een eiermachine zorgt voor een verbeterde bacteriedetector Hoeveel protonen zitten er in azijn?
Hoeveel protonen zitten er in azijn?  Kwantumresonanties nabij het absolute nulpunt
Kwantumresonanties nabij het absolute nulpunt Onderzoek legt de basis voor ultradunne, energiezuinige fotodetector op glas
Onderzoek legt de basis voor ultradunne, energiezuinige fotodetector op glas Infraroodzicht laat onderzoekers door - en in - meerdere lagen grafeen kijken
Infraroodzicht laat onderzoekers door - en in - meerdere lagen grafeen kijken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

