
Wetenschap
Wat is een veel voorkomende oxidatie-reductiereactie?
* brandstof (reductiemiddel): De brandstof, zoals hout, propaan of benzine, bevat chemische bindingen met relatief lage bindingsenergie. Dit betekent dat de elektronen in deze bindingen niet erg strak worden gehouden.
* zuurstof (oxidatiemiddel): Zuurstofgas (O2) heeft een sterke affiniteit voor elektronen.
* De reactie: Wanneer de brandstof en zuurstof in contact komen, "trekt de zuurstof elektronen weg van de brandstof. Deze overdracht van elektronen is het hart van de oxidatiereductie-reactie.
Hier is een vereenvoudigd voorbeeld:
* brandstof: Methaan (CH4)
* zuurstof: Zuurstof (O2)
reactie: CH4 + 2O2 -> CO2 + 2H2O
* oxidatie: Methaan (CH4) verliest elektronen en wordt geoxideerd tot koolstofdioxide (CO2).
* reductie: Zuurstof (O2) krijgt elektronen en wordt gereduceerd tot water (H2O).
Sleutelpunten:
* Energie -release: De overdracht van elektronen laat energie vrij in de vorm van warmte en licht, daarom verbranden we brandstoffen.
* verbranding: Dit is een type oxidatiereductie-reactie die bekend staat als verbranding.
* Belang: Verbranding speelt een cruciale rol in onze energieproductie, transport en vele andere aspecten van het moderne leven.
Andere veel voorkomende voorbeelden:
* roesten van ijzer: IJzer (Fe) reageert met zuurstof (O2) om ijzeroxide te vormen (Fe2O3), beter bekend als roest.
* ademhaling: Levende organismen gebruiken glucose (C6H12O6) als brandstof en zuurstof (O2) om koolstofdioxide (CO2) en water (H2O) te produceren. Dit proces is een complexe oxidatiereductiereactie die energie vrijgeeft om ons lichaam van stroom te voorzien.
* Batterijbewerking: Batterijen vertrouwen op oxidatie-reductiereacties om elektriciteit te genereren.
Laat het me weten als je meer wilt weten over specifieke voorbeelden of aspecten van oxidatie-reductiereacties!
 10 dingen die u kunt doen om de aarde te helpen redden
10 dingen die u kunt doen om de aarde te helpen redden  Zee van plastic:Med-vervuiling in de schijnwerpers tijdens Conservation Meet
Zee van plastic:Med-vervuiling in de schijnwerpers tijdens Conservation Meet Waarom is een kwaliteit dat deel van de aard van de personen?
Waarom is een kwaliteit dat deel van de aard van de personen?  Planten en dieren van Duitsland
Planten en dieren van Duitsland  Hoe het meten van emissies in realtime steden kan helpen om netto nul te bereiken
Hoe het meten van emissies in realtime steden kan helpen om netto nul te bereiken
Hoofdlijnen
- Wat is een diatomee molecuul in de natuur?
- Verschillen langlevende gewassen van jaarlijkse gewassen in hun genetische reactie op menselijke domesticatie?
- Onderzoek onthult hoe twee geslachtschromosomen communiceren tijdens de ontwikkeling van vrouwelijke embryo's
- Opinie:het wegen van in het laboratorium gekweekte biefstuk - de problemen met het eten van vlees zijn geen Silicon Valleys om op te lossen
- Hoe en wat horen vleermuizen?
- Hoe cellen hun afvalverwerkingssystemen opnieuw gebruiken om ontstekingen te bevorderen
- Nation-building of natuurvernietiging? Waarom het tijd is dat NZ de milieuschade van het koloniale verleden het hoofd moet bieden
- Onderzoekers onthullen een nieuw mechanisme van hyaluronzuur met een specifiek molecuulgewicht om de ontsteking van de gastheer te verbeteren
- Waar gaan er precies in het membraan kleine niet -polaire en moleculen door?
- Wetenschappers krijgen een voorproefje van een belangrijk proces in de levensduur van de batterij
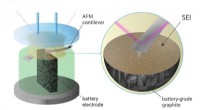
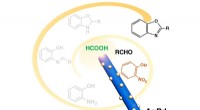
- Nieuwe katalysator leidt tot efficiëntere productie van butadieen

- Onderzoekers ontwikkelen milieuvriendelijke, 4-in-1 katalysator
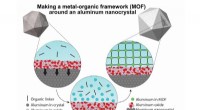
- Onderzoekers voegen poreuze envelop toe aan aluminiumplasmonica
- Wetenschappers ontdekken nieuwe benadering om kathodematerialen te stabiliseren

 Gewassen bij Tsjernobyl nog steeds besmet
Gewassen bij Tsjernobyl nog steeds besmet Millimetergolven voor de laatste mijl
Millimetergolven voor de laatste mijl Wanneer elektriciteit stroomt door de metalen gloeidraad van een gloeilamp elektrische energie wordt omgezet?
Wanneer elektriciteit stroomt door de metalen gloeidraad van een gloeilamp elektrische energie wordt omgezet?  Moleculaire val maakt studie van afzonderlijke eiwitten mogelijk
Moleculaire val maakt studie van afzonderlijke eiwitten mogelijk Waarom denk je dat ultraviolette en zichtbare lichtgolven gewoonlijk worden gemeten in eenheden van nanometers in plaats van meters of centimeters?
Waarom denk je dat ultraviolette en zichtbare lichtgolven gewoonlijk worden gemeten in eenheden van nanometers in plaats van meters of centimeters?  Wetenschappers observeren rechtstreeks de overdracht van licht naar energie in nieuwe zonnecelmaterialen
Wetenschappers observeren rechtstreeks de overdracht van licht naar energie in nieuwe zonnecelmaterialen Wilde planten roepen carnivoren op om ongedierte te verwijderen – kunnen gewassen hetzelfde doen?
Wilde planten roepen carnivoren op om ongedierte te verwijderen – kunnen gewassen hetzelfde doen?  Hoe te lezen Proteïne elektroforese
Hoe te lezen Proteïne elektroforese
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

