
Wetenschap
Welk deel van Atom is verantwoordelijk voor hoe ze omgaan met andere atomen?
* elektronen zijn de sleutel: Atomen interageren met elkaar door elektronen te delen, te doneren of te accepteren. De kern (bevattende protonen en neutronen) is over het algemeen te strak gebonden en neemt niet direct deel aan deze interacties.
* Valence -elektronen zijn de spelers: De valentie -elektronen zijn de elektronen in de buitenste schaal van een atoom. Ze zijn het minst strak gebonden en daarom zijn ze het meest waarschijnlijk betrokken bij chemische binding.
* De elektronenwolk bepaalt gedrag: De verdeling en energieniveaus van de valentie -elektronen in de elektronenwolk bepalen hoe een atoom zal binden aan andere atomen.
* Atomen met weinig valentie -elektronen verliezen ze de neiging om stabiliteit te bereiken, waardoor positieve ionen worden gevormd.
* Atomen met veel valentie -elektronen hebben de neiging elektronen te krijgen om stabiliteit te bereiken, waardoor negatieve ionen worden gevormd.
* Atomen met een matig aantal valentie -elektronen delen vaak elektronen met andere atomen, waardoor covalente bindingen worden gevormd.
Voorbeelden:
* natrium (NA): Heeft één valentie -elektron. Het verliest gemakkelijk dit elektron om een Na+ -ion te vormen, waardoor het kan interageren met andere atomen, zoals chloor.
* chloor (CL): Heeft zeven valentie -elektronen. Het krijgt gemakkelijk één elektron om een cl-ion te vormen, interactie met natrium om NaCl (tafelzout) te vormen.
* koolstof (c): Heeft vier valentie -elektronen. Het deelt gemakkelijk elektronen met andere atomen en vormt vier covalente bindingen, waardoor het complexe organische moleculen kan creëren.
Samenvattend zijn de elektronenwolk en specifiek de valentie -elektronen de belangrijkste spelers om te bepalen hoe atomen met elkaar omgaan om moleculen en verbindingen te vormen.
 Hoe bepalen de samenstellende chemische groepen de pI van arginine?
Hoe bepalen de samenstellende chemische groepen de pI van arginine?  Wat is de chemische naam van Caho?
Wat is de chemische naam van Caho?  Robotachtige zachte materie buigt, draait en kruipt wanneer geraakt met licht
Robotachtige zachte materie buigt, draait en kruipt wanneer geraakt met licht Wat is het niveau van Fermi zijn afhankelijkheid van temperatuur en onzuiverheidsconcentratie?
Wat is het niveau van Fermi zijn afhankelijkheid van temperatuur en onzuiverheidsconcentratie?  Leg uit of de omgekeerde verzadigingsstroom verandert met de temperatuur of niet?
Leg uit of de omgekeerde verzadigingsstroom verandert met de temperatuur of niet?
 Het ritme van verandering:wat een drumbeat-experiment onthult over culturele evolutie
Het ritme van verandering:wat een drumbeat-experiment onthult over culturele evolutie  Mountain Lion Poop
Mountain Lion Poop Wie deelt soortgelijke ervaringen met klimaatverandering in een wereld van 1,5 graden Celsius en daarbuiten?
Wie deelt soortgelijke ervaringen met klimaatverandering in een wereld van 1,5 graden Celsius en daarbuiten?  Wat is de relatie tussen absorptie van altraviolent licht?
Wat is de relatie tussen absorptie van altraviolent licht?  Welke effecten hebben chloorfluorkoolstoffen op de mens?
Welke effecten hebben chloorfluorkoolstoffen op de mens?
Hoofdlijnen
- Wat brengen geïntercaleerde schijven over van cel naar cel?
- Welke lymfoïde organen zijn goed ontwikkeld bij de geboorte?
- Welke technologie was nodig voordat de celtheorie zich ontwikkelde?
- Een enkel eiwit controleert verouderingssignalen effectiever dan in een team
- Hoe een RNA-gen een heel chromosoom tot zwijgen brengt
- Wanneer het menselijk lichaam zijn verdediging tegen een ziekteverwekkers mobiliseert, herkent pathogenen?
- Nieuwe atlas biedt ongekende inzichten over hoe genen functioneren in de vroege embryo-ontwikkeling
- De VS heeft de ergste uitbraak van vogelgriep in twee jaar op de eierboerderij in Iowa
- Zeehaaien en roggen gebruiken ureum om de voortplanting te vertragen, zo blijkt uit onderzoek
- Scanning tunneling microscopie metingen identificeren actieve plaatsen op katalysatoren

- Rekbare zonnecellen een stap dichterbij

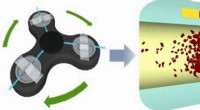
- Fidget spinner als centrifuge scheidt bloedplasma
- Het bewaren van de inhoud van de New York Public Library in een theelepel eiwit, zonder energie, voor miljoenen jaren

- Wijnpolyfenolen kunnen bacteriën afweren die gaatjes en tandvleesaandoeningen veroorzaken

 Waarom gebruiken wetenschappers Bat Box?
Waarom gebruiken wetenschappers Bat Box?  Nanobuisjes en energie:hype of hoop?
Nanobuisjes en energie:hype of hoop?  Forensische taalkunde geeft slachtoffers en ten onrechte veroordeelden de stemmen die ze verdienen
Forensische taalkunde geeft slachtoffers en ten onrechte veroordeelden de stemmen die ze verdienen Wetenschapsexperimenten met planten voor kinderen
Wetenschapsexperimenten met planten voor kinderen Nieuw onderzoek identificeert de belangrijkste wereldwijde supply chain-koppelingen
Nieuw onderzoek identificeert de belangrijkste wereldwijde supply chain-koppelingen Nieuwe ontdekking beëindigt al lang bestaand debat over fotovoltaïsche materialen
Nieuwe ontdekking beëindigt al lang bestaand debat over fotovoltaïsche materialen Egypte zegt 4, 400 jaar oude tombe ontdekt buiten Caïro
Egypte zegt 4, 400 jaar oude tombe ontdekt buiten Caïro Xerox houdt vast aan HP-aanbod, stelt maandag deadline in
Xerox houdt vast aan HP-aanbod, stelt maandag deadline in
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

