
Wetenschap
Is de alkyle -groep zich terugtrekt?
Alkylgroepen worden over het algemeen als elektronen-donerend beschouwd. Dit komt omdat ze een hogere elektronendichtheid hebben dan de waterstofatomen die ze vervangen.
Hier is een uitsplitsing:
* inductief effect: Alkylgroepen hebben een licht positief inductief effect (+I -effect). Dit betekent dat ze de elektronendichtheid naar het aangesloten atoom duwen (vaak een koolstofatoom in een organisch molecuul). Dit maakt het bijgevoegde atoom iets negatiever en de alkylgroep iets positiever.
* Hyperconjugation: Alkylgroepen kunnen ook deelnemen aan hyperconjugatie, een stabiliserende interactie waarbij elektronen in C-H-bindingen overlappen met lege orbitalen op aangrenzende atomen. Dit verhoogt verder de elektronendichtheid van de alkylgroep en draagt bij aan het elektronen-donerende karakter.
Het inductieve effect is echter relatief zwak. In sommige gevallen kunnen andere factoren opwegen tegen het elektronen-donerende effect van alkylgroepen. Bijvoorbeeld:
* sterische hindering: Grote alkylgroepen kunnen de benadering van andere moleculen of substituenten belemmeren, wat leidt tot een ander effect op het totale molecuul.
* Specifieke functionele groepen: De aanwezigheid van zeer elektronegatieve atomen of groepen binnen de alkylgroep kan de elektronische eigenschappen aanzienlijk veranderen.
Conclusie:
Hoewel alkylgroepen over het algemeen elektronen-donerend zijn, is het belangrijk om de specifieke alkylgroep en de algemene context van het molecuul te overwegen bij het bepalen van de elektronische eigenschappen.
 Hoe wordt dicalciumfosfaat gemaakt?
Hoe wordt dicalciumfosfaat gemaakt?  Video:Caesars laatste adem en Einsteins koelkast kwijt
Video:Caesars laatste adem en Einsteins koelkast kwijt Wanneer de CO2 -concentratie in cellen van een C3 -plant laag is in vergelijking met O2, combineert een enzym RUBP in plaats van welk effect zou dit hebben op fotosynthese?
Wanneer de CO2 -concentratie in cellen van een C3 -plant laag is in vergelijking met O2, combineert een enzym RUBP in plaats van welk effect zou dit hebben op fotosynthese?  Wetenschappers stellen redoxmechanisme voor water-gasverschuivingsreactie voor
Wetenschappers stellen redoxmechanisme voor water-gasverschuivingsreactie voor Hoe heet het als je een vaste stof smelt?
Hoe heet het als je een vaste stof smelt?
Hoofdlijnen
- Hoe wordt de mannelijke sekscel uit een pollenkorrel genoemd?
- Hoe worden cellen in de epidermis vervangen?
- Wat zijn mycosterolen?
- Team evalueert landbouwbeheerpraktijken in de nieuwe lachgasboekhoudingsmethode
- Hoeveel chromosomen hebben de mens in profase?
- Hoe kleine chromosomen met grote concurreren om de aandacht van een cel
- Onderzoek toont aan hoe machinaal leren sociaal verzorgingsgedrag kan identificeren aan de hand van versnellingssignalen bij wilde bavianen
- Een beroemde Franse wetenschapper wiens naam begint met C?
- Wie heeft er baat bij menselijke experimenten?
- Realtime dampanalyse kan de training van explosievendetecterende honden verbeteren

- Adsorberen of niet adsorberen? Dat is de vraag

- Een moleculaire snelkookpan maakt taaie stukjes eiwit mals en helpt af te bijten
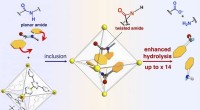
- Vol hete lucht en er trots op:Gasopslag verbeteren met MOF's

- Enzym-aangedreven protocellen stijgen naar de top
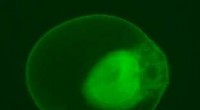
 Stromende cellen in een golvend microkanaal voor effectieve celsortering op basis van grootte
Stromende cellen in een golvend microkanaal voor effectieve celsortering op basis van grootte Patent talk:overgangslenzen op klaarlichte dag voor AR
Patent talk:overgangslenzen op klaarlichte dag voor AR Bottom-up benadering nodig om zoetwaterbloei te bestuderen
Bottom-up benadering nodig om zoetwaterbloei te bestuderen Wat is de concentratie van een HBr-oplossing in 12,0 ml geneutraliseerd door 15,0 0,25 M KOH-oplossing?
Wat is de concentratie van een HBr-oplossing in 12,0 ml geneutraliseerd door 15,0 0,25 M KOH-oplossing?  Twitter-medewerkers vertelden dat ze vanuit huis moesten werken vanwege angst voor virussen
Twitter-medewerkers vertelden dat ze vanuit huis moesten werken vanwege angst voor virussen Onderzoekers verkrijgen eerste directe observatie van facetvorming in nanokubussen
Onderzoekers verkrijgen eerste directe observatie van facetvorming in nanokubussen Uit documenten blijkt dat Volkswagen zich verzette tegen het terugroepen van de Takata-airbags
Uit documenten blijkt dat Volkswagen zich verzette tegen het terugroepen van de Takata-airbags  Duiken in waterbehandelingsstrategieën voor zwembaden
Duiken in waterbehandelingsstrategieën voor zwembaden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

