
Wetenschap
Wat is de concentratie van een HBr-oplossing in 12,0 ml geneutraliseerd door 15,0 0,25 M KOH-oplossing?
De concentratie van de HBr-oplossing kan worden bepaald met behulp van de formule:
$$M_1V_1 =M_2V_2$$
Waar:
M1 =Concentratie van HBr-oplossing (onbekend)
V1 =Volume HBr-oplossing (12,0 ml)
M2 =Concentratie van KOH-oplossing (0,25 M)
V2 =Volume KOH-oplossing (15,0 ml)
Als we de waarden in de formule vervangen, krijgen we:
$$M_1 \maal 12,0 \texttt{ ml} =0,25 \texttt{ M} \maal 15,0 \texttt{ ml}$$
Als we M1 oplossen, krijgen we:
$$M_1 =\frac{0,25 \texttt{ M} \times 15,0 \texttt{ ml}}{12,0 \texttt{ ml}}$$
$$M_1 =0,3125 \texttt{ M}$$
Daarom is de concentratie van de HBr-oplossing 0,3125 M.
 NASA vindt tropische depressie 13W aan de zuidoostkust
NASA vindt tropische depressie 13W aan de zuidoostkust Kolencentrales Azië maken zich zorgen over klimaatdoelen:IEA
Kolencentrales Azië maken zich zorgen over klimaatdoelen:IEA Eten keizerspinguïns genoeg? Wetenschappers meten het foerageersucces door te spioneren met time-lapse-video
Eten keizerspinguïns genoeg? Wetenschappers meten het foerageersucces door te spioneren met time-lapse-video  Brandweerlieden beschermen observatorium op de piek van Zuid-Californië
Brandweerlieden beschermen observatorium op de piek van Zuid-Californië Kopen, lenen of leasen:kunnen we heroverwegen hoe en wanneer we toegang krijgen tot huishoudelijke producten om de klimaatverandering aan te pakken?
Kopen, lenen of leasen:kunnen we heroverwegen hoe en wanneer we toegang krijgen tot huishoudelijke producten om de klimaatverandering aan te pakken?
Hoofdlijnen
- Het oudste DNA ter wereld laat zien hoe mammoeten evolueerden
- Het is wiskundig onmogelijk om veroudering te verslaan, wetenschappers zeggen:
- Taxonomie (biologie): definitie, classificatie en voorbeelden
- Rolmodelstamcellen:hoe immuuncellen zichzelf kunnen vernieuwen
- Meer bewijs dat Neanderthalers niet dom waren:ze maakten hun eigen touwtje
- Eerste referentiegenomen op chromosoomniveau van de sierbanaan en de roze banaan
- De temperatuur in cellen meten
- Onderzoekers ontdekken een mechanisme waarmee bacteriën met hetzelfde genotype een ander fenotype kunnen vertonen
- Opnieuw nadenken over hoe cellen reageren op stress
- Origami diagnostisch apparaat biedt betaalbare malariadiagnoses

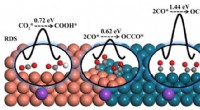
- Afstemming van reactiebarrières voor elektroreductie van kooldioxide tot producten met meerdere koolstofatomen
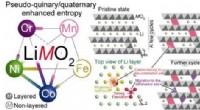
- Onderzoekers ontsluiten potentiële middelen om de afhankelijkheid van zeldzame metalen te verminderen
- Nieuwe katalysator voor het maken van brandstoffen uit schaliegas

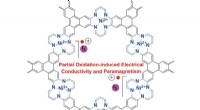
- Nieuw 2D metalen organisch raamwerk met interessante elektrische geleidbaarheid en magnetische eigenschappen
 Wat is het kookpunt van steenkool?
Wat is het kookpunt van steenkool?  IJs verloren, eiland gevonden?
IJs verloren, eiland gevonden?  Astronomen vinden Jupiter-achtige wolkenbanden op de dichtstbijzijnde bruine dwerg
Astronomen vinden Jupiter-achtige wolkenbanden op de dichtstbijzijnde bruine dwerg Nanosponzen nemen keer op keer olie op
Nanosponzen nemen keer op keer olie op Geslachtschromosomen:waarom de Y-genen ertoe doen
Geslachtschromosomen:waarom de Y-genen ertoe doen  Betrouwbare kwaliteitscontrole van grafeen en andere 2D-materialen is routinematig mogelijk, onderzoekers zeggen:
Betrouwbare kwaliteitscontrole van grafeen en andere 2D-materialen is routinematig mogelijk, onderzoekers zeggen: Een onzichtbare coating om hout brandveilig te maken
Een onzichtbare coating om hout brandveilig te maken Wetenschappers van Argonne zijn de eersten die grafeen op zilver kweken
Wetenschappers van Argonne zijn de eersten die grafeen op zilver kweken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

