
Wetenschap
Wat is kristalstructuur van CaO2?
Dit is waarom:
* Instabiliteit: Calciumperoxide is een zeer reactieve verbinding die gemakkelijk ontleedt in calciumoxide (CAO) en zuurstofgas (O2). Deze ontleding vindt zelfs bij kamertemperatuur plaats.
* ontledingsproducten: De ontleding van CaO2 wordt thermodynamisch begunstigd, wat betekent dat het energie vrijgeeft en stabieler is in zijn ontbonden vorm.
* beperkte studies: Vanwege de instabiliteit zijn er beperkte studies naar de kristalstructuur van CaO2.
Sommige theoretische berekeningen suggereren echter dat CaO2 mogelijk zou kunnen bestaan in een kristalstructuur vergelijkbaar met de antifluorietstructuur. Deze structuur wordt gekenmerkt door een gezichtsgericht kubisch rooster waar de calciumionen (Ca2+) de hoeken en gezichtscentra bezetten, en de peroxide-ionen (O22-) de tetrahedrale interstitiële locaties bezetten.
Belangrijke opmerking: Het is zeer onwaarschijnlijk dat het CaO2 in een stabiele kristallijne vorm onder normale omstandigheden vindt. Het is vooral bekend als een tijdelijk tussenproduct in verschillende chemische reacties.
 De beroemde espen van Colorado zal naar verwachting afnemen als gevolg van klimaatverandering
De beroemde espen van Colorado zal naar verwachting afnemen als gevolg van klimaatverandering Australië beleeft warmste dag ooit
Australië beleeft warmste dag ooit De atmosfeer op grote hoogte observeren met behulp van onbemande luchtvaartuigen
De atmosfeer op grote hoogte observeren met behulp van onbemande luchtvaartuigen Verschillende plaatinterfaces gevonden in de overgangszone van de mantel
Verschillende plaatinterfaces gevonden in de overgangszone van de mantel Zweet, bleekmiddel en luchtkwaliteit in de sportschool
Zweet, bleekmiddel en luchtkwaliteit in de sportschool
Hoofdlijnen
- Hoe gebruikt RNA-polymerase DNA?
- Kunnen bevers een chronische slopende ziekte krijgen?
- Indringende vraag:Waarom overleefden zoogdieren het 'K/T-uitsterven'?
- Oedogonium Life Cycle
- Wat legt eieren in water?
- Wat gebeurt er met glucose die samen met filtraat de nefron binnenkomt?
- Wetenschappers bepalen hoe regenboogforel op de juiste manier kan worden gevoerd
- De mannelijke reproductieve structuur van niet -vasculaire planten wordt genoemd?
- Geen levend fossiel:hoe de Coelacanth onlangs tientallen nieuwe genen heeft ontwikkeld
- Onderzoek levert potentiële bioblendstock op voor dieselbrandstof

- Onderzoekers bereiken doorbraak in proces om waterstofbrandstof te produceren

- Op weg naar de volgende generatie op moleculen gebaseerde magneten
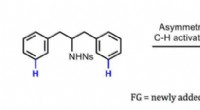
- Chemici bereiken belangrijke mijlpaal van synthese:chirale inductie op afstand
- Geneesmiddeldiversiteit in bacteriën
 Enorme Puerto Rico radiotelescoop, al beschadigd, stort in
Enorme Puerto Rico radiotelescoop, al beschadigd, stort in Eerste lockdown-effect op luchtvervuiling werd overschat, onze studie onthult
Eerste lockdown-effect op luchtvervuiling werd overschat, onze studie onthult VS trekt bevel om visa voor buitenlandse studenten te weigeren in
VS trekt bevel om visa voor buitenlandse studenten te weigeren in Het Londense bedrijf vernieuwt de beloning door het personeel de salarissen te laten bepalen
Het Londense bedrijf vernieuwt de beloning door het personeel de salarissen te laten bepalen Wat is ongeveer de snelheid van een gammadeeltje?
Wat is ongeveer de snelheid van een gammadeeltje?  Waarom is DNA-replicatie belangrijk voor de celcyclus?
Waarom is DNA-replicatie belangrijk voor de celcyclus?  De vervuilingsregels van Trump worden teruggedraaid om steenkoolland hard te raken
De vervuilingsregels van Trump worden teruggedraaid om steenkoolland hard te raken Huawei verkoopt opvouwbare smartphone zonder Google na Amerikaans verbod
Huawei verkoopt opvouwbare smartphone zonder Google na Amerikaans verbod
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

