
Wetenschap
Hoe is enthalpie gerelateerd aan het spontaan van een reactie?
h =u + pv
Hoewel enthalpie zelf niet direct de spontaniteit van een reactie bepaalt, speelt de verandering ervan (AH) een cruciale rol. Hier is hoe:
1. Exotherme reacties (ΔH <0):
* Laat warmte vrij in de omgeving.
* Gunstig in termen van enthalpie , terwijl het systeem energie verliest, waardoor het stabieler wordt.
* Echter niet altijd spontaan , omdat andere factoren zoals entropie het proces kunnen beïnvloeden.
2. Endotherme reacties (ΔH> 0):
* absorbeer warmte uit de omgeving.
* ongunstig in termen van enthalpie , omdat het systeem energie krijgt, waardoor het minder stabiel is.
* Meestal niet spontaan , die externe energie -input vereisen om door te gaan.
Gibbs Free Energy (G):
Om spontaniteit nauwkeurig te voorspellen, moeten we rekening houden met zowel enthalpieverandering (AH) als entropie -verandering (AS) met behulp van Gibbs Free Energy (G):
ΔG =ΔH - Tδs
* δs> 0: Verhoogde aandoening of willekeur in het systeem, over het algemeen gunstig.
* t: Temperatuur in Kelvin.
Spontaniteit en Gibbs vrije energie:
* ΔG <0: Reactie is spontaan (gunstig) onder gegeven omstandigheden.
* ΔG> 0: Reactie is niet-spontaan (ongunstig) onder gegeven omstandigheden.
* ΔG =0: Reactie is in evenwicht, waar voorwaartse en omgekeerde snelheden gelijk zijn.
Samenvattend:
Enthalpy Change alleen garandeert geen spontaniteit. Gibbs vrije energie, die zowel enthalpie als entropie opneemt, is de ultieme indicator van de vraag of een reactie spontaan zal verlopen onder specifieke omstandigheden.
 NASA-infraroodbeelden tonen tropische storm Renes wip van kracht
NASA-infraroodbeelden tonen tropische storm Renes wip van kracht LA County zal tegen 2053 drie keer zoveel warme dagen ervaren, zegt onderzoek
LA County zal tegen 2053 drie keer zoveel warme dagen ervaren, zegt onderzoek Wetenschappers stellen nieuw concept voor terrestrische planeetvorming voor
Wetenschappers stellen nieuw concept voor terrestrische planeetvorming voor Waarom heeft Darwin de wetten van Mendel niet ontdekt?
Waarom heeft Darwin de wetten van Mendel niet ontdekt?  Video:De milieu-impact van online winkelen
Video:De milieu-impact van online winkelen
Hoofdlijnen
- Hoe wordt het genoemd als een procedure waarin iets is gemeten of waargenomen buiten het levende organisme?
- Welk proces vormde de Grandcayon?
- Hoe leren ziekteverwekkers ziekteverwekkers te zijn:partnerschappen tussen microben die leiden tot ziekte bij de mens
- Jill Brown over waarom bedrijven als ‘kwaadaardig’ worden bestempeld
- Golgi-apparaat: functie, structuur (met analogie en diagram)
- Drones die ziekten bij gewassen vroegtijdig opsporen, stuwen landbouwonderzoek vooruit
- Onderzoek toont aan hoe de vogelgriep kan worden uitgeroeid door de genen van kippen te bewerken
- Wat is de functie van het Trp-operon?
- Verdraaide seks zorgt ervoor dat slakken in spiegelbeeld face-to-face kunnen paren, onderzoek vindt
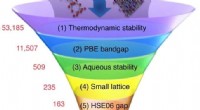
- Uitgebreide elektronische structuurmethoden voor materiaalontwerp
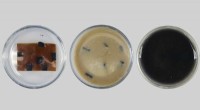
- Ontwerpmateriaal om plastic buiten de vuilstort te houden
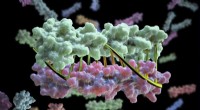
- Wetenschappers programmeren eiwitten om precies te paren
- Residu van stabilisator in inkten blijkt de geleidbaarheid in 3D-geprinte elektronica te remmen

- Sterke constructies realiseren met koolstofvezelversterkte kunststoffen

 16 miljoen jaar oud fossiel toont springstaarten die liften op gevleugelde termieten
16 miljoen jaar oud fossiel toont springstaarten die liften op gevleugelde termieten Duitsland stemt ermee in om drones van Israëlische makelij te leasen:fabrikant
Duitsland stemt ermee in om drones van Israëlische makelij te leasen:fabrikant Hoe maak je een Shoebox Biome voor school
Hoe maak je een Shoebox Biome voor school  Nieuwe studie laat zien hoe vogels samenwerken om samen te zingen
Nieuwe studie laat zien hoe vogels samenwerken om samen te zingen Bijen gebruiken onzichtbare warmtepatronen om bloemen te kiezen
Bijen gebruiken onzichtbare warmtepatronen om bloemen te kiezen Hoe planten goede buren worden in tijden van stress
Hoe planten goede buren worden in tijden van stress  Weer een bruine dwerg in het systeem? Studie onderzoekt eigenschappen van HD 206893
Weer een bruine dwerg in het systeem? Studie onderzoekt eigenschappen van HD 206893 Li-ionen transport over elektrolyten en SEI
Li-ionen transport over elektrolyten en SEI
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

