
Wetenschap
Waarom samentrekken stoffen als ze afkoelen?
* Kinetische energie en temperatuur: Temperatuur is een maat voor de gemiddelde kinetische energie van de moleculen in een stof. Hoe hoger de temperatuur, hoe sneller de moleculen bewegen en trillen.
* Moleculaire afstand: Bij hogere temperaturen hebben moleculen meer kinetische energie, waardoor ze meer vaker bewegen en vaker botsen. Dit resulteert in een grotere gemiddelde afstand tussen moleculen.
* Koeling en samentrekking: Wanneer een stof afkoelt, vertragen de moleculen, nemen hun trillingen af en botsen ze minder vaak. Met deze vermindering van kinetische energie kunnen de moleculen dichter bij elkaar komen, wat resulteert in een afname van het volume - de stofcontracten.
Uitzonderingen:
* Water: Terwijl de meeste stoffen samentrekken wanneer ze afkoelen, gedraagt water zich ongewoon tussen 0 ° C en 4 ° C. In dit bereik breidt water zich uit als het afkoelt. Dit komt door de unieke waterstofbindingsstructuur van watermoleculen, die verandert naarmate de temperatuur daalt.
* Faseveranderingen: De samentrekking die we meestal zien, is binnen een specifieke fase van materie (vaste, vloeistof, gas). Wanneer een stof fase verandert (bijvoorbeeld vloeibaar water in vast ijs), zijn volumeveranderingen belangrijker en kunnen expansie inhouden.
Samenvattend: Het koelen van een stof vermindert de kinetische energie van zijn moleculen, waardoor ze dichter bij elkaar komen en resulteren in contractie. Dit geldt voor de meeste stoffen, maar heeft enkele uitzonderingen zoals water in een specifiek temperatuurbereik.
 Hoeveel elektronen hebben stikstof en broom in de buitenste schil?
Hoeveel elektronen hebben stikstof en broom in de buitenste schil?  Hoe kunnen we waterstof verkrijgen van een mengsel van en koolmonoxide?
Hoe kunnen we waterstof verkrijgen van een mengsel van en koolmonoxide?  Door elektronische verstoring bevorderd grensvlakpad voor gemakkelijke C-H-dissociatie
Door elektronische verstoring bevorderd grensvlakpad voor gemakkelijke C-H-dissociatie  Onderzoek biedt hoop op eenvoudigere diagnose en behandeling van kanker
Onderzoek biedt hoop op eenvoudigere diagnose en behandeling van kanker Zal Alka-Seltzer sneller in tweeën oplossen?
Zal Alka-Seltzer sneller in tweeën oplossen?
 Een deel van de Stille Oceaan warmt niet op zoals verwacht, kopen waarom?
Een deel van de Stille Oceaan warmt niet op zoals verwacht, kopen waarom? Het noordpoolgebied wordt bruin
Het noordpoolgebied wordt bruin Deep learning-applicatie die El Niño-gebeurtenissen tot 18 maanden van tevoren kan voorspellen
Deep learning-applicatie die El Niño-gebeurtenissen tot 18 maanden van tevoren kan voorspellen Hoe tomatenplanten hun wortels gebruiken om water te rantsoeneren tijdens droogte
Hoe tomatenplanten hun wortels gebruiken om water te rantsoeneren tijdens droogte  Studie vindt mogelijke instabiliteit in het watercirculatiesysteem van de Atlantische Oceaan
Studie vindt mogelijke instabiliteit in het watercirculatiesysteem van de Atlantische Oceaan
Hoofdlijnen
- Verborgen microbioom versterkt dieren, ook planten
- Nog twee walvissen sterven in Australië terwijl het aantal gestrande doden de 200 bereikt
- Hoe classificeren aboringinale mensen organismen?
- Waarom is het celmembraan en de muur nodig?
- Onderzoekers vergroten het inzicht in waarom celonderdelen er zo uitzien zoals ze eruitzien
- Nieuwe aanwijzing gevonden in buitenaardse goudvis suggereert dat het mogelijk een weekdier was
- Welke soort interactie tussen levende wezens is gebaseerd op voedsel?
- Hoe ziet een Angleshark -organisme eruit?
- Tribunelichten van 9/11 kunnen gevaarlijk zijn voor vogels studie zegt:
- Ontwerpbehandeling van geavanceerde metalen voor betere beeldhouwkunst

- Arylradicaalvorming door splitsing van arylhalogenidebindingen door een N-heterocyclische carbeenkatalysator
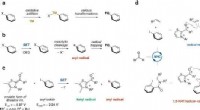
- Lithiumionen stromen door vast materiaal
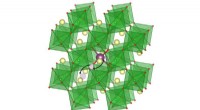
- Een legering die zijn geheugen behoudt bij hoge temperaturen

- Hiërarchisch mesoporeuze titaniumdioxidematerialen voor energie- en milieutoepassingen
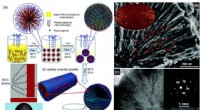
 Zuurstof gekoppeld aan de opkomst en ondergang van de vroege evolutie van dieren
Zuurstof gekoppeld aan de opkomst en ondergang van de vroege evolutie van dieren Op Medicaid? Amazon biedt ontvangers een Prime-korting
Op Medicaid? Amazon biedt ontvangers een Prime-korting Race is begonnen om het Great Salt Lake te redden:zal het genoeg zijn?
Race is begonnen om het Great Salt Lake te redden:zal het genoeg zijn? gesmeerd, nanogestructureerde oppervlakken verbeteren de prestaties van condensors in energie- en ontziltingsinstallaties, onderzoek vindt
gesmeerd, nanogestructureerde oppervlakken verbeteren de prestaties van condensors in energie- en ontziltingsinstallaties, onderzoek vindt De huidige hype en hysterie van AI kan de technologie tientallen jaren terugzetten
De huidige hype en hysterie van AI kan de technologie tientallen jaren terugzetten Atomaire antennes ontwikkelen voor kwantumdetectie
Atomaire antennes ontwikkelen voor kwantumdetectie Hoeveel centimeter in 12,7 mm?
Hoeveel centimeter in 12,7 mm?  Facebook waarschuwt gebruikers die van corona-hoaxes hielden
Facebook waarschuwt gebruikers die van corona-hoaxes hielden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

