
Wetenschap
Structuur en binding van waterstofsulfide?
Structuur en binding van waterstofsulfide (H₂s)
Structuur:
* Moleculaire vorm: Gebogen of V-vormig.
* bindingshoek: Ongeveer 92 °.
* Hybridisatie: SP 3 Hybridisatie op het zwavelatoom.
* polariteit: Polair molecuul.
binding:
* Type bindingen: Twee covalente bindingen tussen zwavel en elk waterstofatoom.
* elektronegativiteit: Zwavel (2.58) is meer elektronegatief dan waterstof (2.20).
* Polaire covalente bindingen: Vanwege het verschil in elektronegativiteit wordt het elektronenpaar in elke S-H-binding enigszins verschoven naar het zwavelatoom, waardoor een gedeeltelijke negatieve lading op zwavel en een gedeeltelijke positieve lading op elk waterstofatoom ontstaat. Dit resulteert in een polaire covalente binding.
* eenzame paren: Zwavel heeft twee eenzame paren elektronen die verantwoordelijk zijn voor de gebogen vorm van het molecuul en bijdragen aan de polariteit ervan.
Diagram:
`` `
H
|
S
/ \
H H
`` `
eigenschappen:
* geur: Rotte eiergeur.
* kleurloos gas Bij kamertemperatuur.
* giftig en brandbaar.
* Oplosbaarheid: Enigszins oplosbaar in water.
Sleutelpunten:
* De gebogen vorm van H₂s is te wijten aan de aanwezigheid van alleenstaande paren op het zwavelatoom, die de bindingselektronenparen afstoten.
* De polariteit van H₂s is te wijten aan het ongelijke delen van elektronen in de S-H-obligaties, die een dipoolmoment creëert.
* De eigenschappen van H₂s worden beïnvloed door zijn structuur en binding. De sterke geur is bijvoorbeeld te wijten aan het vermogen om te interageren met reukreceptoren in de neus.
Samenvattend heeft H₂s een gebogen vorm, polaire covalente bindingen en twee eenzame paren op het zwavelatoom. De structuur- en bindingseigenschappen zijn verantwoordelijk voor zijn karakteristieke eigenschappen, inclusief zijn sterke geur, toxiciteit en ontvlambaarheid.
 Voel je je alleen in je eco-angst? Niet doen - het is opmerkelijk gebruikelijk om angst te voelen over achteruitgang van het milieu
Voel je je alleen in je eco-angst? Niet doen - het is opmerkelijk gebruikelijk om angst te voelen over achteruitgang van het milieu Kom je er overheen? Als het om gerecycled water gaat, zullen consumenten dat niet doen
Kom je er overheen? Als het om gerecycled water gaat, zullen consumenten dat niet doen  Algoritme om motregen-turbulentie-interacties vast te leggen, zou de voorspellingen van toekomstige klimaatomstandigheden kunnen verbeteren
Algoritme om motregen-turbulentie-interacties vast te leggen, zou de voorspellingen van toekomstige klimaatomstandigheden kunnen verbeteren Op welke twee manieren kan verwering van een standbeeld plaatsvinden?
Op welke twee manieren kan verwering van een standbeeld plaatsvinden?  Pijn tijdens genezing:ziekenhuispersoneel ontheemd door bosbrand
Pijn tijdens genezing:ziekenhuispersoneel ontheemd door bosbrand
Hoofdlijnen
- Wat zijn de vijanden van een Blauwe Morpho-vlinder?
- De symbolische aap? Door tokens gemedieerde economische keuzes in getufte kapucijnen
- Wat gebruiken chloroplasten om glucose te maken?
- Een lijst met vijf kenmerken van chromosomen
- Wat is een verbinding die de groei en reproductie van bacteriën blokkeert?
- Wetenschapsprojecten: een skelet maken
- Wat zijn 10 takken van wetenschap en definiëren ze elk?
- Hoe hangen vissen en vogels samen? Onderzoekers vinden dat het antwoord een doelbewuste wake is
- Onderzoek levert inzicht op in hoe plantencellen groeien
- Binnenkort:een bloedtest voor de ziekte van Alzheimer?

- Een robuust materiaal voor de opname en opslag van ammoniak met dichtheden die dicht bij die van het vloeibaar gemaakte gas liggen
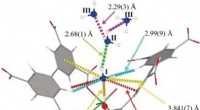
- De eiwitten die de biosynthese van formicamycine behouden

- Wetenschappers ontwikkelen technologie om tumorcellen te vangen

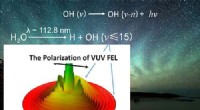
- Studie onthult fotolyse van water en de bijdragen ervan aan hydroxyl-daggloedemissies in de atmosfeer van de aarde en Mars
 Een op de 4 restaurants gaat niet meer open na pandemie studie zegt:
Een op de 4 restaurants gaat niet meer open na pandemie studie zegt: 10 keer heeft het iets anders geregend dan water
10 keer heeft het iets anders geregend dan water  Wormen die in Sheetrock graven
Wormen die in Sheetrock graven  Hoe wolken worden gemaakt
Hoe wolken worden gemaakt  Rusland zegt dat lekkage van ruimtestation sabotage kan zijn
Rusland zegt dat lekkage van ruimtestation sabotage kan zijn Verfijning van deeltjes induceert en verhoogt de cycluscapaciteit van natrium/lithium-ionbatterijen
Verfijning van deeltjes induceert en verhoogt de cycluscapaciteit van natrium/lithium-ionbatterijen Welke schaal wordt gebruikt om de hardheid of zachtheid van mineralen te rangschikken?
Welke schaal wordt gebruikt om de hardheid of zachtheid van mineralen te rangschikken?  Wilde kapucijnapen met baard weten echt hoe ze een noot moeten kraken
Wilde kapucijnapen met baard weten echt hoe ze een noot moeten kraken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

