
Wetenschap
Welk gas is chemisch vergelijkbaar met alkali -metalen?
Dit is waarom:
* Elektronische configuratie: Zowel alkali -metalen als waterstof hebben slechts één elektron in hun buitenste schaal. Dit enkele valentie -elektron is verantwoordelijk voor hun vergelijkbare reactiviteit.
* De neiging om elektronen te verliezen: Alkali -metalen verliezen gemakkelijk hun enkele valentie -elektron om een +1 ion te vormen. Evenzo kan waterstof zijn enkele elektron verliezen om een proton (H+) te vormen, hoewel dit minder gebruikelijk is dan het verkrijgen van een elektron om een hydride-ion (H-) te vormen.
* Reactiviteit: Zowel alkali -metalen als waterstof zijn zeer reactief. Alkali -metalen reageren krachtig met water en reageren gemakkelijk met niet -metalen. Waterstof reageert ook met veel elementen, vooral bij verhoogde temperaturen.
Het is echter belangrijk op te merken dat:
* waterstof is een niet -metaal: Hoewel het enkele chemische overeenkomsten deelt met alkali -metalen, wordt waterstof geclassificeerd als een niet -metal vanwege zijn fysische eigenschappen zoals zijn diatome gasvormige toestand bij kamertemperatuur.
* waterstof is een veel kleiner atoom: Dit verschil in grootte kan leiden tot verschillende chemische gedragingen.
Hoewel waterstof enkele overeenkomsten met alkali -metalen deelt, wordt het daarom niet beschouwd als een echt lid van de groep.
 Chaperones kunnen eiwitten in niet-evenwichtstoestanden vasthouden
Chaperones kunnen eiwitten in niet-evenwichtstoestanden vasthouden Welke vaste stof vormt een uitzondering op de regel dat vaste stoffen een hogere dichtheid hebben dan vloeistoffen?
Welke vaste stof vormt een uitzondering op de regel dat vaste stoffen een hogere dichtheid hebben dan vloeistoffen?  Wat is de empirische formule van methaan?
Wat is de empirische formule van methaan?  Welke binding is C2H6?
Welke binding is C2H6?  Bloed en zweet:draagbare medische sensoren krijgen een grote gevoeligheidsboost
Bloed en zweet:draagbare medische sensoren krijgen een grote gevoeligheidsboost
 Onderzoek naar de link tussen onderwijs en klimaatverandering
Onderzoek naar de link tussen onderwijs en klimaatverandering Hoe helpt water een plant?
Hoe helpt water een plant?  Gewonde planten:hoe ze hun genezing coördineren
Gewonde planten:hoe ze hun genezing coördineren  Grote transnationale bedrijven spelen een cruciale rol in het wereldwijde beheer van natuurlijke hulpbronnen
Grote transnationale bedrijven spelen een cruciale rol in het wereldwijde beheer van natuurlijke hulpbronnen Wat zijn vier natuurlijke diensten die ecosystemen bieden voor de biosfeer?
Wat zijn vier natuurlijke diensten die ecosystemen bieden voor de biosfeer?
Hoofdlijnen
- Wat zijn enkele wetenschappelijke websites?
- Waarom zijn spechten bestand tegen hoofdletsel?
- De functie van macromoleculen
- Knollen in de problemen
- Wat zou er gebeuren als de micro -organismen uit de voedselketen werden verwijderd?
- Onderzoekers fabriceren geminiaturiseerde bionische oceaanbatterij
- Hoe origami ziektediagnoses kan bepalen
- Wat is vogelgriep, de ziekte die de virale TikTok-emu Emmanuel treft?
- Waar komen de ingrediënten in dat broodje vandaan? Onze wereldwijde nutriëntentracker vertelt een complex verhaal
- Nieuw membraan kan de weg vrijmaken voor goedkope, efficiënt gemaakte biobrandstoffen

- grafeen, perovskieten, en silicium - een ideale tandem voor efficiënte zonnecellen

- 3D-printen van zetmeel voor gepersonaliseerde medicijnontwikkeling

- Kanker op ground zero aanpakken met designer moleculen

- Herbruikbare waterbehandelingsdeeltjes elimineren effectief BPA
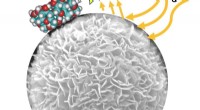
 Singlet-zuurstof breekt selectief oxytetracycline af in fenton-achtige oxidatie
Singlet-zuurstof breekt selectief oxytetracycline af in fenton-achtige oxidatie Eiwit om acute hersenbloeding te stoppen
Eiwit om acute hersenbloeding te stoppen Opinie:waarom en hoe debatteren over klimaatverandering
Opinie:waarom en hoe debatteren over klimaatverandering Atoomplaatsing van elementen telt mee voor sterk beton
Atoomplaatsing van elementen telt mee voor sterk beton Wat doet desinfectiemiddel als chemische stof?
Wat doet desinfectiemiddel als chemische stof?  Tesla-aandelen stuiteren omdat Musk het risico als overdreven wordt beschouwd
Tesla-aandelen stuiteren omdat Musk het risico als overdreven wordt beschouwd Moderne beschaving vermindert geweld niet
Moderne beschaving vermindert geweld niet Welk systeem voert de organische functies uit van inname -digestie en uitscheiding?
Welk systeem voert de organische functies uit van inname -digestie en uitscheiding?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

