
Wetenschap
Kan barium worden gecombineerd met elementen?
Gemeenschappelijke verbindingen:
* zuurstof: Barium reageert gemakkelijk met zuurstof om bariumoxide (BAO) te vormen, een witte vaste stof. Deze reactie is zo krachtig dat barium vaak wordt opgeslagen onder olie of een inerte atmosfeer om te voorkomen dat het met lucht reageert.
* halogenen: Barium reageert krachtig met halogenen (fluor, chloor, broom en jodium) om haliden zoals bariumfluoride (BAF₂), bariumchloride (BACL₂), bariumbromide (BABR₂) en bariumjodide (bai₂) te vormen.
* Water: Barium reageert heftig met water om bariumhydroxide (BA (OH) ₂) en waterstofgas te produceren.
* zuren: Barium reageert met zuren om bariumzouten en waterstofgas te vormen.
* zwavel: Barium reageert met zwavel om bariumsulfide te vormen (BAS).
* koolstof: Barium kan reageren met koolstof om bariumcarbide te vormen (BAC₂).
Minder veel voorkomende verbindingen:
* stikstof: Barium kan nitriden vormen zoals bariumnitride (Ba₃n₂) onder specifieke omstandigheden.
* Phosporus: Het kan ook verbindingen vormen met fosfor zoals bariumfosfide (BA₃P₂).
Opmerking: Bariumverbindingen zijn vaak giftig, dus het hanteren ervan vereist voorzichtigheid.
Belangrijke overwegingen:
* De reactiviteit van barium maakt het moeilijk om het in zijn zuivere elementaire vorm te vinden.
* De exacte omstandigheden (temperatuur, druk, aanwezigheid van katalysatoren) kunnen beïnvloeden welke verbindingen worden gevormd.
Samenvattend kan barium worden gecombineerd met een breed scala aan elementen om een veelheid aan verbindingen te vormen, waarvan vele belangrijk zijn in verschillende industriële en wetenschappelijke toepassingen.
 Wat is een voorbeeld van een vaste stof die minder dicht is dan vloeistof?
Wat is een voorbeeld van een vaste stof die minder dicht is dan vloeistof?  Wondbehandelingshydrogel doordrenkt met aminozuren doodt bacteriën op natuurlijke wijze en bevordert de celgroei
Wondbehandelingshydrogel doordrenkt met aminozuren doodt bacteriën op natuurlijke wijze en bevordert de celgroei  De structuur van RNA ontdekken
De structuur van RNA ontdekken Hoe het aantal atomen te berekenen gezien de massa's van gram en atoom
Hoe het aantal atomen te berekenen gezien de massa's van gram en atoom  Kwantumverstrengeling in chemische reacties? Nu is er een manier om daar achter te komen
Kwantumverstrengeling in chemische reacties? Nu is er een manier om daar achter te komen
 Verbeterde waterbehandelingssystemen nodig om verontreinigingen in water te verwijderen
Verbeterde waterbehandelingssystemen nodig om verontreinigingen in water te verwijderen Het meten van de gevolgen voor de volksgezondheid na rampen
Het meten van de gevolgen voor de volksgezondheid na rampen Reis om straling te controleren na het zinken van Russische onderzeeër in 1989
Reis om straling te controleren na het zinken van Russische onderzeeër in 1989 Welke spin kan op water lopen?
Welke spin kan op water lopen?  Vulkanische geo-engineering heeft mogelijk een klimaatcatastrofe veroorzaakt die de meeste diersoorten heeft gedood
Vulkanische geo-engineering heeft mogelijk een klimaatcatastrofe veroorzaakt die de meeste diersoorten heeft gedood
Hoofdlijnen
- Onderzoekers voltooien eerste uitgebreide dreigingsanalyse van alle bomen in de VS
- Zeewier als biobrandstof? Metabolic engineering maakt het een haalbare optie
- Wat kan bacillen doen onder ongunstige omstandigheden?
- Plasmamembraan: definitie, structuur en functie (met diagram)
- Studie analyseert de eigenaardige schedelanatomie van brulapen
- Zure druiven:Besschade, fruitvliegjes verergeren wijn
- Rapport:meer dan 1.000 wilde paarden naar de slachtbank gestuurd
- Slechte zaden:hoe de ouderlijke afstamming de levensvatbaarheid van tomatenhybriden kan bepalen
- Openbare bronnen stimuleren de ontdekking van medicijnen en bieden inzicht in de eiwitfunctie
- Hard als een diamant? Wetenschappers voorspellen nieuwe vormen van superharde koolstof

- Ingenieurs produceren duurzame, energiedichtheid batterij

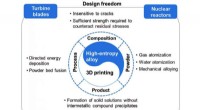
- Onderzoekers beoordelen de vooruitgang in 3D-printen van legeringen met hoge entropie
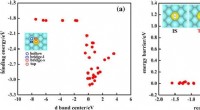
- AI zocht naar single-atom-alloy katalysatoren, 200 veelbelovende kandidaten gevonden
- Water, overal water - en het is vreemder dan je denkt

 Het blootleggen van de redenen achter de snelle opwarming van de Noordpool
Het blootleggen van de redenen achter de snelle opwarming van de Noordpool  Een griezelig goede sensor
Een griezelig goede sensor De geheime oorsprong van China's 40-jarenplan om een einde te maken aan de CO2-uitstoot
De geheime oorsprong van China's 40-jarenplan om een einde te maken aan de CO2-uitstoot Een mineraal dat kan worden afgevlakt zonder te breken?
Een mineraal dat kan worden afgevlakt zonder te breken?  Hoe wordt het voedsel verteerd geabsorbeerd en naar de cellen getransporteerd?
Hoe wordt het voedsel verteerd geabsorbeerd en naar de cellen getransporteerd?  Wil je meedoen aan de uitdaging om de maan te verkennen?
Wil je meedoen aan de uitdaging om de maan te verkennen? financieel, economische acties tijdens een crisis kunnen rationeel zijn, indien niet ethisch
financieel, economische acties tijdens een crisis kunnen rationeel zijn, indien niet ethisch Onderzoek toont aan hoe klimaatverandering de impact van invasieve planten kan verergeren
Onderzoek toont aan hoe klimaatverandering de impact van invasieve planten kan verergeren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

