
Wetenschap
Waar vindt u elementen gegroepeerd die de meest vergelijkbare fysische en chemische eigenschappen hebben?
In het bijzonder zijn ze gegroepeerd binnen dezelfde verticale kolom , die een groep wordt genoemd of familie .
Bijvoorbeeld:
* Groep 1 (Alkali metalen): Lithium (Li), Natrium (NA), Kalium (K), Rubidium (RB), Cesium (CS) en Francium (FR) zijn allemaal zachte, zeer reactieve metalen die gemakkelijk één elektron verliezen om een +1 ion te vormen.
* Groep 17 (halogenen): Fluor (F), chloor (CL), broom (BR), jodium (I) en astatine (AT) zijn allemaal niet -metalen die gemakkelijk één elektron krijgen om een -1 ion te vormen. Ze zijn allemaal zeer reactief en vormen diatomaire moleculen.
Deze gelijkenis in eigenschappen is te wijten aan het feit dat elementen in dezelfde groep hetzelfde aantal valentie -elektronen hebben , die de elektronen zijn in de buitenste schaal van een atoom. Deze valentie -elektronen zijn verantwoordelijk voor het chemische gedrag van een element.
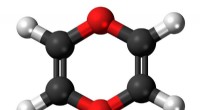
 Welk type atomen worden in een skeletmodel een organisch molecuul getoond?
Welk type atomen worden in een skeletmodel een organisch molecuul getoond?  Op zoek naar werkzame stoffen tegen stressgerelateerde ziekten
Op zoek naar werkzame stoffen tegen stressgerelateerde ziekten  Nieuwe methode maakt geautomatiseerd snel onderzoek van enzymatische processen mogelijk
Nieuwe methode maakt geautomatiseerd snel onderzoek van enzymatische processen mogelijk Hoe goede metalen slecht worden:ontdekking verklaart onverwachte eigenschappen van exotische metaalverbindingen
Hoe goede metalen slecht worden:ontdekking verklaart onverwachte eigenschappen van exotische metaalverbindingen Kooldioxide uit schoorstenen schrobben voor schonere industriële emissies
Kooldioxide uit schoorstenen schrobben voor schonere industriële emissies
 Populair betekent niet invloedrijk onder Cambodjaanse boeren
Populair betekent niet invloedrijk onder Cambodjaanse boeren Wat de droogte in Kaapstad andere steden kan leren over klimaatadaptatie
Wat de droogte in Kaapstad andere steden kan leren over klimaatadaptatie Burgerwetenschap:de ecologische voetafdruk van uw voedsel kennen
Burgerwetenschap:de ecologische voetafdruk van uw voedsel kennen Waarom klimaatverandering het moeilijker maakt om mariene vervuiling te monitoren
Waarom klimaatverandering het moeilijker maakt om mariene vervuiling te monitoren Klimaatverandering zorgt ervoor dat aan land vallende orkanen langer sterker blijven
Klimaatverandering zorgt ervoor dat aan land vallende orkanen langer sterker blijven
Hoofdlijnen
- Wat microben ons kunnen vertellen over het leven op aarde en in de ruimte
- Hoe Spaced Repetition examen tijd een fluitje van een cent kan maken
- Ontdekking van jongens onthult zeer complexe interactie tussen plant en insect
- De beet uit slangengif halen
- Hoe gistchromosomen de slechte breuken vermijden
- Welke twee dingen delen etnische groepen?
- Waarom is biologie belangrijk in de studie van de psychologie?
- Hoe oud is jouw hond in mensenjaren? Wetenschappers ontwikkelen betere methode dan ‘vermenigvuldigen met 7’
- Waar komt genectische variatie vandaan?
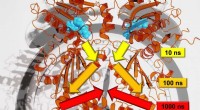
- Onderzoekers onderzoeken signaaloverdracht in eiwitten over meerdere tijdschalen
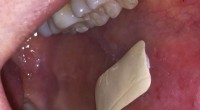
- Gips dat in de mond blijft plakken, kan de behandeling van orale aandoeningen verbeteren
- Onderzoekers synthetiseren hernieuwbare oliën voor gebruik in smeermiddelen

- Van vloeibaar naar vast om de ontwikkeling van membraanloze organellen te stimuleren

- Redoxdivergente strategie voor constructie van (dihydro)thiofenen met dimethylsulfoxide
 Software genereert automatisch brei-instructies voor 3D-vormen
Software genereert automatisch brei-instructies voor 3D-vormen Waarom is de Krebs-cyclus essentieel voor het leven zoals wij dat kennen?
Waarom is de Krebs-cyclus essentieel voor het leven zoals wij dat kennen?  Project heeft tot doel de eerste 4D-kaarten van de aardmantel te maken
Project heeft tot doel de eerste 4D-kaarten van de aardmantel te maken Hoe mitochondriale disfunctie leidt tot vroegtijdige veroudering en ziekte
Hoe mitochondriale disfunctie leidt tot vroegtijdige veroudering en ziekte Recordregen terwijl tyfoon op Zuid-Japanse eilanden slaat
Recordregen terwijl tyfoon op Zuid-Japanse eilanden slaat Versterking van het scenariokader voor klimaatverandering
Versterking van het scenariokader voor klimaatverandering Post van de Amerikaanse posterijen, pakketten worden per zelfrijdende vrachtwagen naar Dallas gebracht
Post van de Amerikaanse posterijen, pakketten worden per zelfrijdende vrachtwagen naar Dallas gebracht Hoe wordt biomassa gebruikt in de echte wereld?
Hoe wordt biomassa gebruikt in de echte wereld?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

